1、填空题 (10分) (1)CH4与CO2的混合气体的密度是相同条件下H2密度的14倍,则混合气体的平均摩尔质量为?,CH4与CO2的分子个数比为?。对于数以千万计的化学物质和为数更多的化学反应,分类法的作用几乎是无可替代的。
(2)现有下列6种物质:CO2、SiO2、CaO、MgO、Fe2O3、C。
按照不同的分类标准,它们中有一种物质与其他5种有明显的不同,请找出这种物质,并写出依据(写出两种分类方法):
①________________________________________②________________________________________。
(3)从上述物质中分别找出两种能相互反应的物质, 各写一个非氧化还原
各写一个非氧化还原 反应的方程式和氧化还原反应的方程式:________________________________,____________________________________
反应的方程式和氧化还原反应的方程式:________________________________,____________________________________
(4)生活中的食醋和淀粉溶液分别属于分散系中的_____和______,用___________可以鉴别(填化学专用名词)。
2、简答题 实验室需用CuSO4?5H2O体配制480mL0.1mol/L的CuSO4溶液,请回答下列问题:
(1)应用托盘天平称取CuSO4?5H2O晶体______g.
(2)若在称量样品时,药品放在天平右盘上,砝码放在天平左盘上(1g以下使用游码),天平平衡时,实际称量的CuSO4?5H2O晶体是______g.
(3)本实验用到的主要仪器有:托盘天平、量筒、烧杯、玻璃棒、______、______.
(4)配制过程中有几个关键的步骤和操作如下图所示:将这些实验步骤A-F按实验过程先后次序排列______.
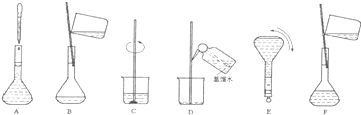
其中定容的具体操作是______.
(5)以下情况会使所配溶液的浓度产生何种影响(A.偏高?B.偏低?C.不变,填序号.):
①溶解晶体用的烧杯和玻璃棒未洗涤.______
②定容时俯视刻度线.______
③所用CuSO4?5H2O晶体已失去部分结晶水.______.
3、选择题 用NA代表阿伏加德罗常数,下列说法正确的是(?)
A.常温下,2LpH=12的Na2CO3溶液中含有的OH—数目为0.02NA
B.5.6gFe粉在0.1molCl2中充分燃烧,转移电子数为0.3NA
C.将100mL 1mol/LFeCl3溶液滴入沸水中,生成胶体粒子0.1NA
D.0.1molNa与O2反应生成Na2O和Na2O2时,转移电子数0.2NA
4、简答题 (1)下列配制100mL?0.100mol?L-1的碳酸钠溶液的操作步骤按先后顺序排列为______(填数字序号).
①将一定质量的碳酸钠置于小烧杯内,用少量水将其溶解
②待溶液冷至室温后,将其完全转移到容量瓶内,摇匀
③计算所需碳酸钠的质量,并用精密天平准确称取
④加水至容量瓶内,使凹液面最低点与容量瓶的刻度线相切,盖上塞子摇匀
⑤检查容量瓶是否渗漏
若量取20.00mL该碳酸钠溶液,应选用的量器是______.
(2)根据现有中学化学知识,判断下列有关实验叙述正确的是______(填序号).
A.检验红砖中氧化铁成分用到的试剂是盐酸和硫氰化钾溶液
B.用冰醋酸、蒸馏水和容量瓶等仪器配制pH为1的醋酸稀溶液
C.中和滴定时,酸式滴定管用蒸馏水清洗3次后,即加入标准盐酸溶液进行滴定
D.实验室用洁净的试管做银镜反应时不能将试管直接放酒精灯火焰上加热
E.由于碘在酒精中的溶解度大,所以可用酒精将碘水中的碘萃取出来.
5、选择题 甲、乙两烧杯中各盛有100mL 3mol·L—1的盐酸和NaOH溶液,向两烧杯中分别加入等质量的铝粉,反应结束后,测得生成的气体体积比为V(甲):V(乙)=1:2,则加入铝粉的质量为(?)
A 5.4g ?B 3.6g ?C 2.7g ?D 1.6g