1、选择题 下列说法正确的是(?)
A.热化学方程式中,若没有注明温度和压强,则表示反应热是在标准状况下测得的数据
B.升高温度或加入催化剂,可以改变化学反应的反应热
C.据能量守恒定律,反应物的总能量一定等于生成物的总能量
D.反应产物的总焓大于反应物的总焓时,反应吸热,ΔH>0
参考答案:D
本题解析:选项A不正确,应该是25℃、1个大气压;催化剂只能改变反应的活化能,但不能改变反应热,选项B不正确;任何化学反应都伴随着能量的变化,所以反应物的总能量一定不等于生成物的总能量,选项C不正确,因此正确的答案选D。
本题难度:一般
2、填空题 2SO2(g)+O2(g) 2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH="-99" kJ·mol-1
2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH="-99" kJ·mol-1
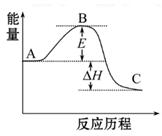
请回答下列问题:
(1)图中A、C分别表示_________、_________,E的大小对该反应的反应热有无影响?_________。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?_________,理由是__________________;
(2)图中ΔH=_________kJ·mol-1;
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒氧化物VO2;四价钒氧化物再被氧气氧化。写出该催化循环机理的化学方程式_____________________________;
(4)已知单质硫的燃烧热为296 kJ·mol-1,计算由S(s)生成3mol SO3(g)的ΔH_______(要求计算过程)。
参考答案:(1)反应物能量?生成物能量?没有影响?因为催化剂改变反应历程使活化能E降低(2)-198
(3)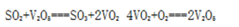
(4)
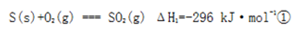
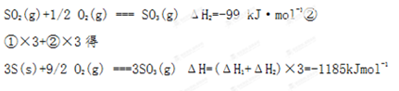
本题解析:由题意1 mol SO2(g)氧化为1 mol SO3(g)的ΔH="-99" kJ·mol-1可知当生成2 mol SO3(g)时ΔH应为-99乘以2为-198 kJ·mol-1
本题难度:一般
3、选择题 用CH4催化还原NOX可以消除氮氧化物的污染,有望解决汽车尾气污染问题,反应如下:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)?△H=-574kJ·mol-1
CH4(g)+4NO(g)=N(g)+CO2(g)+2H2O(g)?△H=-akJ·mol-1
按上述转化,标准状况下44.8LNO2被还原至N2,整个过程中放出的热量为867kJ,则a的值为?(?)
A.1160
B.2308
C.1441
D.2320
参考答案:A
本题解析:略
本题难度:一般
4、填空题 (9分)某温度下,在2L容器中3种物质间进行反应, X、Y、Z的物质的量随时间的变化曲线如图。反应在t1min时到达平衡,依图所示:
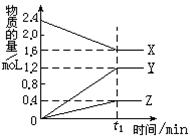
⑴①该反应的化学方程式是_____________________。
②在t1min时,该反应达到了__________状态,下列可作
为判断反应已达到该状态的是________?__(填序号)。
A.X、Y、Z的反应速率相等
B.X、Y的物质的量浓度不再改变
C.生成3molY的同时生成1molZ
D.生成1molZ的同时生成2molX