1、选择题 下列各物质中,既能通过金属与氯气反应,又能通过金属与盐酸反应制得的是
A.MgCl2
B.FeCl2
C.FeCl3
D.CuCl2
参考答案:A
本题解析:略
本题难度:简单
2、选择题 将一条湿润的蓝色石蕊试纸投入盛有Cl2的集气瓶中,试纸将
A.由蓝变白
B.由蓝变紫
C.由蓝变红
D.由蓝变红又变白
参考答案:D
本题解析:Cl2+H2O=HCl+HClO,显酸性且生成的HClO强氧化性可以漂白,所以看到的现象为由蓝变红又变白。答案选D。
本题难度:一般
3、选择题 下列关于氯气的说法错误的是( )
A.密度比空气大
B.有毒
C.黄绿色气体
D.使干燥的有色布条褪色
参考答案:A.氯气的式量为71,空气的平均式量为29,所以氯气的密度大,故A正确;
B.氯气是一种有毒气体,它主要通过呼吸道侵入人体并溶解在黏膜所含的水分里,生成次氯酸和盐酸,对上呼吸道黏膜造成有害的影响,故B正确;
C.氯气是一种黄绿色、有刺激性气味的气体,在低温和加压条件下能转变为液态和固态,故C正确;
D.潮湿的氯气具有漂白性,干燥的氯气不具备漂白性,真正起漂白作用的是次氯酸,潮湿的氯气具有漂白性的原因是:氯气与水反应生成具有漂白性的次氯酸,所以氯气不能使干燥的有色布条褪色,故D错误;
故选D.
本题解析:
本题难度:一般
4、填空题 多原子分子氰(CN)2、硫氰(SCN)2和(OCN)2的性质与Cl2相似,它们也和Cl2一样可以生成酸和盐。见下表:
项目
| 氯气
| 氰
| 硫氰
| ①
|
“单质”
| Cl2
| (CN)2
| (SCN)2
| (OCN)2
|
酸
| HCl
| HCN
| ②
| HOCN
|
盐
| KCl
| KCN
| KSCN
| ③
|
?(1)在表中①②③处应分别填写?、?、?。
(2)完成下列化学方程式:
①HSCN+MnO2
②(CN)2+H2O——
③(OCN)2+KOH——
参考答案:(1)氧氰? HSCN? KOCN
(2)①4HSCN+MnO2 Mn(SCN)2+(SCN)2+2H2O
Mn(SCN)2+(SCN)2+2H2O
②(CN)2+H2O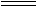 HCN+HCNO
HCN+HCNO
③(OCN)2+2KOH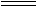 KOCN+KOCNO+H2O
KOCN+KOCNO+H2O
本题解析:这是一道信息题,根据题目所给信息(CN)2、(SCN)2、(OCN)2与Cl2相似,用类比的方法可以得到以下结论:CN、SCN、OCN与Cl相似;CN-、SCN-、OCN-与Cl-相似。因此,由Cl2与H2O、KOH,HCl与MnO2的反应可推得(CN)2与H2O,HSCN与MnO2,(OCN)2与KOH的反应的化学方程式。思考时注意(CN)、(SCN)、(OCN)均和Cl一样,是一个整体,不可将它们拆开,导致思路复杂化和错解。
本题难度:简单
5、填空题 研究CO、SO2、NO等大气污染气体的综合处理与利用具有重要意义。
(1)以CO或CO2与H2为原料,在一定条件下均可合成甲醇,你认为用哪种合成设计线路更符合“绿色化学”理念:(用化学反应方程式表示)?。
(2)如图所示是用于合成甲醇产品中甲醇含量的检测仪。写出该仪器工作时的电极反应式:
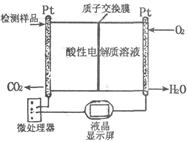
负极?,正极?。
(3)一定条件下,NO2和SO2反应生成SO3(g)和NO两种气体,现将体积比为1:2的NO2和SO2的混合气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是?。(填序号)
A.体系压强保持不变
B.混合气体颜色保持不变
C.SO3、NO的体积比保持不变
D.每消耗 1 mol SO2,同时生成1 mol NO