1、选择题 某同学用下列装置制备并检验Cl2的性质。下列说法正确的是( )
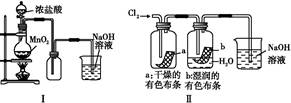
A.Ⅰ图中:如果MnO2过量,盐酸可全部被消耗
B.Ⅱ图中:湿润的有色布条褪色,证明Cl2有漂白性
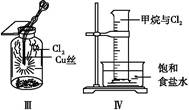
C.Ⅲ图中:生成棕色的固体,证明Cl2有强氧化性
D.Ⅳ图中:光照后量筒中气体体积减小,说明甲烷与Cl2发生了加成反应
参考答案:C
本题解析:Ⅰ图中随着反应进行浓盐酸变为稀盐酸,MnO2与之不反应,A项错误;Cl2使湿润的有色布条褪色是因为Cl2与水反应:Cl2+H2O HCl+HClO,其中HClO具有漂白性,B项错误;CH4与Cl2在光照条件下发生取代反应,D项错误。
HCl+HClO,其中HClO具有漂白性,B项错误;CH4与Cl2在光照条件下发生取代反应,D项错误。
本题难度:一般
2、选择题 通过对实验现象的观察、分析推理得出结论是化学学习的方法之一。对下列实验事实解释正确的是
?
| 现象
| 解释
|
A
| KI淀粉溶液中通入Cl2,溶液变蓝
| Cl2能与淀粉发生显色反应
|
B
| 浓硝酸在光照条件下变黄
| 浓硝酸不稳定,生成有色产物能溶于浓硝酸
|
C
| 在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液后溶液的红色褪去
| BaCl2溶液具有酸性
|
D
| 向盐酸中加入浓硫酸时产生白雾
| 浓硫酸具有脱水性
|
?
参考答案:B
本题解析:加入BaCl2后,平衡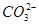 +H2O
+H2O OH-+
OH-+ 左移,碱性减弱,C选项错误;D选项是浓硫酸的吸水性。
左移,碱性减弱,C选项错误;D选项是浓硫酸的吸水性。
本题难度:简单
3、选择题 Cl2和SO2都具有漂白作用,若将等物质的量的这两种气体混合通入品红与BaCl2的混合液,能观察到的现象是( )
A.溶液很快褪色
B.溶液不褪色
C.出现沉淀
D.不出现沉淀
参考答案:Cl2和SO2等物质的量混合通入品红与BaCl2的混合液中发生反应Cl2+SO2+2H2O=H2SO4+2HCl,生成的H2SO4和BaCl2反应生成BaSO4白色沉淀,Cl2和SO2按1:1恰好反应,所以品红不会褪色,故选BC.
本题解析:
本题难度:一般
4、实验题 (15分)下图是一套制取并验证氯 气部分化学性质的实验装置。
气部分化学性质的实验装置。
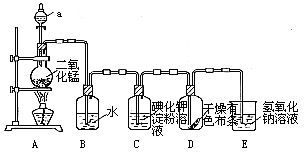
反应的方程式:MnO2+4HCl(浓) MnCl2+2H2O+ Cl2↑回答下列问题:
MnCl2+2H2O+ Cl2↑回答下列问题:
(1)上述反应中氧化剂是____?,还原剂是__?__。
(2)当Cl2气流通过一段时间后,装置B中溶液的pH值____7(填“>”“<”或“=”),写出Cl2与水反应的方程式?.??
(3)当有少量Cl2气流通过后,观察到装置C中的溶液变为_?___色,反应的离子方程式为?_,这个实验证明氯气的氧化性比碘单质?_?___(填“强”或“弱”).
(4)当Cl2气流持续通过时装置D中干燥的有色布条能否褪色?为什么?
?。
(5)装置E的作用是__?_。
(6)制取标况下氯气4.48升,至少需要MnO2?克。(Mn-55,O-16)
参考答案:(1) _MnO21分, _?HCl1分_。(2) __<?略2分
(3)略? 2分?强_?1分_.
(4)?不能?略? 2分。
(5)吸收尾气? 2分_。
(6)17.4 2分
本题解析:略
本题难度:一般
5、填空题 海水是巨大的资源宝库。从海水中提取食盐和溴的过程如下:
?
 (1)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br?,其目的为富集溴元素,请写出步骤Ⅱ的化学方程式,并用双线桥法标出电子转移的方向与数目。(4分)
(1)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br?,其目的为富集溴元素,请写出步骤Ⅱ的化学方程式,并用双线桥法标出电子转移的方向与数目。(4分)
?
 (2)
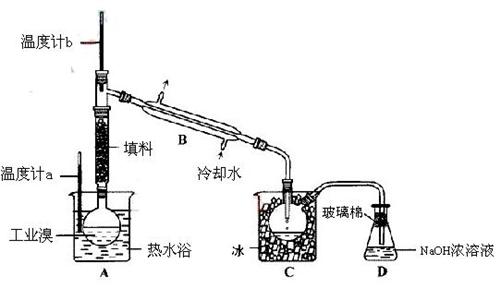
(2) 某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃。微溶于水,有毒性和强腐蚀性。他们参观生产过程后,设计了如下装置简图:
某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃。微溶于水,有毒性和强腐蚀性。他们参观生产过程后,设计了如下装置简图:

 请你参与分析讨论:
请你参与分析讨论:

 ①图中仪器B的名称: 。(1分)
①图中仪器B的名称: 。(1分)
 ②
②  实验装置气密性良好,要在C中获得纯净的液溴即达到提纯溴的目的,操作中如何控制关键条件: ? 。(2分)
实验装置气密性良好,要在C中获得纯净的液溴即达到提纯溴的目的,操作中如何控制关键条件: ? 。(2分)
 ③为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,则发生的反应方程式为
③为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,则发生的反应方程式为
?(2分)
充分反应后,再进行的分离操作是 ? 。(1分)
参考答案:(1)略
(2) ①冷凝管
②控制温度达59℃(2分)
③Cl2+2NaBr="2NaCl+" Br2 (2分)
?萃取分液
本题解析:略
本题难度:简单