1、选择题 将5.1g镁铝合金投入到500mL 2 mol/L的盐酸中,金属完全溶解,再加入250mL的NaOH溶液,若要使生成的沉淀最多,则应加入的这种NaOH溶液的物质的量浓度是( )
A.1mol/L
B.2mol/L
C.3mol/L
D.4mol/L
参考答案:D
本题解析:略
本题难度:一般
2、填空题 铝土矿(主要成分为Al2O3,还有少量杂质)是提取氧化铝的原料。提取氧化铝的工艺流程如下:
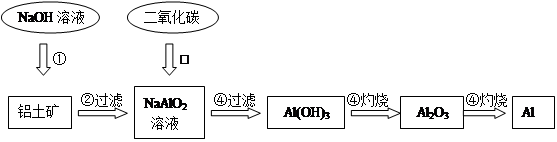
(1)请用离子方程式表示以上工艺流程中第①步反应:_______?_______。
(2)写出以上工艺流程中第③步反应的化学方程式:______?___________。
(3)金属铝与氧化铁混合在高温下,会发生剧烈的反应。该反应的化学方程式_____________。请举一例该反应的用途________________。
(4)电解熔融氧化铝制取金属铝,若有0.9mol电子发生转移.理论上能得到金属铝的质量是________________。
参考答案:(1)Al2O3+2OH-=2AlO2-+H2O?
(2)NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3?
(3)2Al+Fe2O3 2Fe+Al2O3:?焊接铁轨
2Fe+Al2O3:?焊接铁轨
(4)8.1g
本题解析:(1)因题目已经给出了铝土矿的主要成分是Al2O3,所以第一步反应中与NaOH溶液反应的是Al2O3,Al2O3+2OH-=2AlO2-+H2O
(2)结合实验室制取Al(OH)3的原理,我们可以写出反应方程式NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
(3)铝热反应方程式:2Al+Fe2O3=2Fe+Al2O3。
(4)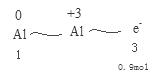
所以可以推出反应的铝为0.3mol,质量为0.3mol*27g/mol=8.1g
本题难度:一般
3、选择题 下列过程中,最终的白色沉淀不一定是BaSO4的是

A.Fe(NO3)2溶液----→白色沉淀
B.Ba(NO3)2溶液-----→白色沉淀
C.无色溶液----→白色沉淀
D.无色溶液----→无沉淀-----→白色沉淀
参考答案:C
本题解析:分析:A.硝酸根离子在酸性条件下相当于硝酸;
B.硝酸根离子在酸性条件下相当于硝酸,亚硫酸根被硝酸氧化成硫酸根;
C.可能生成白色的AgCl沉淀;
D.加过量盐酸排除了Ag+碳酸根离子等的干扰;
解答:
A.硝酸亚铁中有硝酸根离子存在,加入过量的稀盐酸,就相当于硝酸存在,通入二氧化硫气体,二氧化硫与水生成亚硫酸,被硝酸氧化成硫酸根离子,加氯化钡,最终生成BaSO4沉淀,故A正确;
B.硝酸钡溶液中有硝酸根离子存在,加入过量的稀盐酸,就相当于硝酸存在,加入亚硫酸钠,亚硫酸根离子被硝酸氧化成硫酸根离子,所以一定是硫酸钡白色沉淀,故B正确;
C.无色溶液加入稀硝酸,加入氯化钡,Ag+可能干扰,最终生成的白色沉淀可能是AgCl或BaSO4,故C错误;
D.无色溶液,加盐酸无沉淀,就排除了亚硫酸钡和氯化银,因为亚硫酸钡会和盐酸生成二氧化硫和水,再加上氯化钡有生成沉淀,所以一定是硫酸钡白色沉淀,故D正确;
故选C.
点评:本题考查了离子间的反应,掌握常见的离子的性质是解答的关键,难度不大.
本题难度:简单
4、选择题 铬(Cr)与铝的性质相似,Cr(OH)3+OH- =CrO- 2+2H2O,下列推断中正确的是
A.往CrCl3溶液加入过量NaOH溶液可制得Cr(OH)3
B.对CrCl3·6H2O加热脱水可得CrCl3
C.Cr2O3既能溶于酸,又能溶于NaOH溶液
D.CrO- 2水解使溶液显酸性
参考答案:C
本题解析:铬(Cr)与铝的性质相似,A、往CrCl3溶液加入过量NaOH溶液得NaCrO2,错误;B、CrCl3·6H2O加热脱水会水解,得到的是Cr(OH)3,错误;C、根据题意Cr2O3具有两性既能溶于酸,又能溶于NaOH溶液,正确;D、CrO- 2+2H2O= Cr(OH)3↓+OH-,正确。
本题难度:一般
5、填空题 将一定质量的镁铝合金样品全部溶于100mL某浓度的盐酸中。向所得溶液中滴加5.0mol/L的NaOH溶液,生成沉淀质量与加入的NaOH溶液体积关系如右图所示。求:
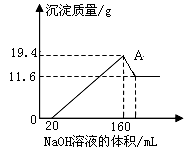
(1)A点沉淀物的化学式为 _?。
(2)原合金中的Mg 、Al质量各多少克?
(3)盐酸的物质的量浓度。
参考答案:(1)Mg(OH)2、 Al(OH)3 。
(2) Mg 4.8g、Al2.7g
(3)c(HCl)=0.8mol/0.1L=8mol·L-1
本题解析:从图中横坐标可以看出,加入20mL的氢氧化钠溶液时,没有产生沉淀,此段是盐酸与氢氧化钠发生中和反应;当氢氧化钠继续加入时,沉淀不断增加,沉淀为氢氧化镁和氢氧化铝,直到沉淀最大值;继续添加氢氧化钠,则氢氧化铝参与反应,生成偏铝酸钠。故11.6g沉淀是氢氧化镁,(19.4-11.6)g是氢氧化铝的质量。根据守恒法可知,n(Mg)=n(Mg(OH)2)= 11.6g÷58g/mol=0.2mol,故镁的质量为0.2mol×24g/mol=4.8g。同理可求出铝的质量为2.7g。当氢氧化钠加入量为160mL时,溶质均为NaCl,根据守恒法可知,n(HCl)=n(Cl-)=n(NaOH)=0.16L×5.0mol/L=0.8mol。
点评:金属及其化合物是重要的无机物,是历年高考的重点。考生在备考过程中应注意积累各物质的性质及重要的化学反应。
本题难度:一般