1、选择题 草酸是二元弱酸,KHC2O4溶液呈酸性.对于0.1mol/L?KHC2O4,下列关系正确的是(? )
A.c(K+)+c(H+)=c(HC2O4-)+c(OH-)+c(C2O42-)
B.c(HC2O4-)+c(C2O42-)=0.1mol/L
C.c(K+)=c(H2C2O4)+c(HC2O4-)+c(C2O42-)
D.c(C2O42-)<c(H2C2O4)
参考答案:C
本题解析:
本题难度:一般
2、选择题 下列电离方程式正确的是
A.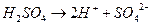
B.CH3COOH→CH3COO-+H+
C.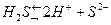
D.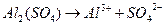
参考答案:A
本题解析:略
本题难度:简单
3、选择题 将0.2mol·L-1HCN溶液和0.1mol·L-1的NaOH溶液等体积混合后,溶液显碱性,下列关系式中正确的是
A.c (HCN)<c (CN-)
B.c (Na+) = c (CN-)
C.c (HCN)-c (CN-)=c (OH-)
D.c (HCN)+c (CN-)=0.1mol·L-1
参考答案:D
本题解析:试题分析:将0.2mol·L-1HCN溶液和0.1mol·L-1的NaOH溶液等体积混合后,生成NaCN,其中HCN是过量的。个有关的数据可知,NaCN和HCN的物质的量浓度都是0.05mol/L。溶液显碱性,说明NaCN的水解程度大于HCN的电离程度,所以c (HCN)>c (CN-)。根据电荷守恒可知c (Na+)+c (H+) = c (CN-)+c (OH-),溶液显碱性,则c (H+) <c (OH-),所以c (Na+) > c (CN-),ABC不正确。根据物料守恒可知c (HCN)+c (CN-)=0.1mol·L-1,D正确,答案选D。
考点:考查溶液中离子浓度大小比较的有关判断
点评:该题是中等难度的试题,也是高考中的常见题型。试题基础性强,难易适中,有利于培养学生的逻辑推理能力和发散思维能力。该题的关键是利用好电荷守恒、物料守恒以及质子守恒。
本题难度:困难
4、选择题 某合作学习小组讨论辨析以下说法:
①粗盐和酸雨都是混合物;
②氯化钠溶液、溴化钾、铜都是电解质;
③冰和干冰既是纯净物又是化合物;
④不锈钢和目前流通的硬币都是合金;
⑤明矾等常见铝盐可用于净水;
⑥生石灰和熟石灰都是碱;
⑦氧化剂和还原剂相遇一定会发生氧化还原反应
其中说法正确的是
[? ? ]
A、①②③④
B、①③④⑤
C、③⑤⑥⑦
D、①②⑤⑥
参考答案:B
本题解析:
本题难度:简单
5、选择题 下列排列顺序正确的是( )
A.常温下将0.1mol?L-1CH3COONa溶液与0.05mol?L-1HCl溶液等体积混合,c(Na+)>c(Cl-)>c(CH3COO-)>c(OH-)>c(H+)
B.常温下物质的量浓度相等的①NH4HSO4;②CH3COONH4;③NH4Cl三种溶液中c(NH4+):①>③>②
C.常温下0.1mol?L-1的NaHA溶液,其pH=11,则溶液中:c(HA-)>c(OH-)>c(A2-)>c(H2A)
D.在相同条件下,将足量AgCl分别加入等体积的①0.01mol?L-1KCl;②0.1mol?L-1KCl溶液;③蒸馏水,三种液体中,所能溶解的AgCl质量关系为:①>②>③
参考答案:A、因混合后溶液中含等量的NaCl、HAc及CH3COONa,酸与盐的混合溶液显酸性,则c(H+)>c(OH-),故A错误;
B、设浓度都为1mol/L,①中氢离子抑制铵根离子的水解,则①中铵根离子的浓度最接近1mol/L,②中发生相互促进水解,则铵根离子的浓度最小,③中铵根离子水解则铵根离子的浓度小于1mol/L,所以三种溶液中c(NH4+)的关系为①>③>②,故B正确;
C、pH=11,则HA-的水解大于其电离,水解生成H2A,电离生成A2-,则c(H2A)>c(A2-),故C错误;
D、AgCl?Ag++Cl-中,氯离子浓度越大,AgCl溶解的越小,三种溶液中氯离子的浓度关系为②>①>③,则能溶解的AgCl质量关系为③>①>②,故D错误;
故选B.
本题解析:
本题难度:一般