1、选择题 下列说法中,正确的是
[? ]
A.强电解质的水溶液一定比弱电解质溶液的导电能力强
B.强电解质都是离子化合物,弱电解质都是共价化合物
C.强电解质的水溶液中不存在溶质分子
D.不溶性盐都是弱电解质,可溶性酸和具有极性键的化合物都是强电解质。
参考答案:C
本题解析:
本题难度:简单
2、选择题 下列说法正确的是( )
A.在NaHCO3溶液中一定有:c(Na+)+c(H+)=c?(HCO3-)+c?(CO32-)+c?(OH-)
B.0.1?mol?L-1的NaHS溶液中离子浓度关系:c(OH-)=c?(H+)-c(S2-)+c(H2S)
C.NaOH与CH3COOH混合液中,可能出现:c(OH-)>c(Na+)>c(H+)>c(CH3COO-)
D.将标况下的2.24LCO2通入150mL?1mol/LNaOH溶液中:c(HCO3-)<c(CO32-)
参考答案:A.在NaHCO3溶液中存在电荷守恒:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),故A错误;
B.NaHS溶液中存在电荷守恒:c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-),物料守恒:c(Na+)=c(S2-)+c(HS-)+c(H2S),二者联式可得:c(OH-)=c(H+)-c(S2-)+c(H2S),故B正确;
C.OH-参加反应,则应有c(Na+)>c(OH-),故C错误;
D.n(CO2)=0.1mol,c(NaOH)=0.15mol,n(CO2):c(NaOH)=0.1mol:0.15mol=2:3,发生2CO2+3NaOH=Na2CO3+NaHCO3+H2O,由于CO32-水解程度大于HCO3-,则c(HCO3-)>c(CO32-),故D错误.
故选B.
本题解析:
本题难度:简单
3、选择题 下列物质的水溶液均能导电,但属于非电解质的是
A.SO2
B.Cl2
C.MgSO4
D.KOH
参考答案:A
本题解析:试题分析:电解质是指在水溶液或熔化状态下能导电的化合物,而非电解质是指在水溶液和熔化状态下都不能导电的化合物.A.二氧化硫为化合物,其水溶液能导电,但其本身不发生电离,则属于非电解质,正确;B.氯气是单质,不是化合物,不是非电解质,错误;C. 硫酸镁为化合物,其水溶液能导电,它是电解质,错误;D. 氢氧化钾为化合物,其水溶液能导电,它是电解质,错误。
考点:电解质和非电解质
本题难度:困难
4、填空题 某二元酸(化学式用H2B表示)在水中的电离方程式是:H2B===H++HB-? HB-?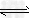 H++B2-?
H++B2-?
回答下列问题:
(1)Na2B溶液显________(填“酸性”“中性”或“碱性”),理由是_____________________。(用离子方程式表示)
(2)在0.1?mol·L-1?Na2B溶液中,下列粒子浓度关系式正确的是________。
A.c(Na+)+(OH-)=c(H+)+c(HB-)
B.c(Na+)+c(H+)=c(OH-)+c(HB-)+2c(B2-)
C.c(Na+)=2c(B2-)+2c(HB-)
(3)已知0.1?mol·L-1?NaHB溶液的pH=2,则0.1mol·L-1?H2B溶液中氢离子的物质的量浓度可能是________?0.11?mol·L-1(填“<”“>”或”=”),理由是_____________________。
(4)0.1?mol·L-1?NaHB溶液中各种离子浓度由大到小的顺序是_______________。
参考答案:(1)碱性 ;B2- +H2O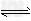 HB-+OH-?
HB-+OH-?
(2)BC
(3)< ;第一步电离产生的H+抑制了HB-的电离
(4)c(Na+)>c(HB-)>c(H+)>c(B2-)>c(OH-)
本题解析:
本题难度:一般
5、选择题 在25?mL?0.1?mol·L-1?NaOH溶液中逐滴加入0.2?mol·L-1 CH3COOH溶液,溶液pH变化曲线如图所示,下列有关离子浓度的比较正确的是?

[? ]
A.对于曲线上AB间任一点,溶液中都有: c(Na+)?>c(CH3COO-)?>c(OH-)?>c(H+)
B.在B点,a>12.5,且有 c(Na+)?=?c(CH3COO-)?=?c(OH-)?=?c(H+)
C.在C点,c(CH3COO-)?-?c(Na+)?=?c(H+)?-?c(OH-)
D.在D点,c(CH3COO-)?+?c(CH3COOH)?=?c(Na+)
参考答案:C
本题解析:
本题难度:一般