|
|
|
高中化学必备知识点《水的电离平衡》考点预测(2019年强化版)(三)
2019-06-28 20:26:16
【 大 中 小】
|
1、选择题 下列方程式中书写正确的是
[? ]
A.CO32-?+2H2O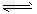 H2CO3?+?2OH-? H2CO3?+?2OH-?
B.NaHCO3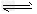 Na++H++CO32- Na++H++CO32-
C.HClO?==?H++ClO-?
D.H2S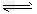 H++HS-;HS- H++HS-;HS-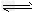 H++S2- H++S2-
2、填空题 (16分)根据题给信息,完成下列各小题:
Ⅰ、某造纸厂排出的废水,经取样分析其中除了含有游离汞、纤维素以及其它的有机物外,其它成分为c(Na+)=4×10—4mol/L,c(SO42—)=2.5×10—4mol/L,c(Cl—)=1.6×10—5 mol/L,c(NO3—)=1.4×10—5 mol/L,c(Ca2+)=1.5×10—5 mol/L,则该废水的pH为________。
Ⅱ、有四种一元酸HA、HB、HC、HD,相同物质的量浓度的NaD和NaB溶液的pH,前者比后者大;NaA溶液呈中性;1mol/L的KC溶液遇酚酞试液呈红色;同体积、同物质的量浓度的HB、HC分别作导电性试验,发现后者的导电性比前者强,则这四种酸的酸性由强到弱的顺序为______________________。
Ⅲ、常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得
溶液的pH如下表:
实验编号
| HA物质的量浓度(mol/L)
| NaOH物质的量浓度(mol/L)
| 混合溶液的pH
| ①
| 0.1
| 0.1
| pH=9
| ②
| c
| 0.2
| pH=7
| ③
| 0.2
| 0.1
| pH<7
|
请回答:
(1)从①组情况分析,HA是强酸还是弱酸__________(填“强酸”或“弱酸”);
(2)①组实验所得混合溶液中由水电离出的c(OH-)=__________mol·L-1。
(3)②组情况表明,c__________0.2 mol/L(选填“大于”、“小于”或“等于”)。
混合液中离子浓度c(A-)与c(Na+)的大小关系是___________。
(4)从③组实验结果分析,说明HA的电离程度__________NaA的水解程度(选填“大于”、“小于”或“等于”),该混合溶液中离子浓度由大到小的顺序是__________。
3、选择题 向体积为Va的0.1mol·L-1 CH3COOH溶液中加入体积为Vb的0.1mol·L-1 KOH溶液,下列关系错误的是( )
A.Va>Vb时:c(CH3COOH) + c(CH3COO-)> c(K+)
B.Va=Vb时:c(CH3COOH) + c(H+) = c(OH-)
C.Va<Vb时:c(CH3COO-) > c(K+)> c(OH-)>(H+)
D.Va与Vb任意比时:c(K+)+ c(H+) =c(OH-)+ c(CH3COO-)
|
4、填空题 工业废水随意排放会造成严重污染,根据成分不同可采用不同的处理方法。
(1)电池生产工业废水中常含有Cu2+等重金属离子,常用FeS等难溶物质作为沉淀剂除去。已知室温下Ksp(FeS)=6.3×10-18mol2·L-2,Ksp(CuS)=1.3×10-36mol2·L-2。
①请用离子方程式说明上述除杂的原理 。
②FeS高温煅烧产生的SO2气体通入下列溶液中,能够产生沉淀的是 (填序号)
A.Ba(NO3)2
B.BaCl2
C.Ba(OH)2
D.溶有NH3的BaCl2溶液
|
③若将足量SO2气体通入0.2 mol·L-1的NaOH溶液,所得溶液呈酸性,则溶液中离子浓度由大到小的顺序为
。
(2)采用电解法处理含有Cr2O72-的酸性废水,在废水中加入适量NaCl,用铁电极电解一段时间后,有Cr(OH)3和Fe(OH)3沉淀生成,从而降低废水中铬元素的含量。若阳极用石墨电极则不能产生Cr(OH)3沉淀,用必要的化学语言说明原因___________________。
(3)废氨水可以转化成氨,氨再设计成碱性燃料电池。如图是该燃料电池示意图,产生的X气体可直接排放到大气中。a电极作
极(填“正”“负”“阴”或“阳”),其电极反应式为
;T℃下,某研究员测定NH3·H2O的电离常数为1.8×10-5,NH4+的水解平衡常数为1.5×10-8(水解平衡也是一种化学平衡,其平衡常数即水解常数),则该温度下水的离子积常数为
,请判断T
25℃(填“>”“<”“=”)。

5、选择题 常温时,在pH都等于9的NaOH和CH3COONa两种溶液中,设由水电离产生的OH- 离子浓度分别为Amol/L与Bmol/L,则A和B关系为 ( )
A.A>B
B.A=10-4 B
C.B=10-4 A
D.A=B
