1、简答题 A、B、C、D、E原子序数依次递增的五种短周期元素,已知:
①B原子核外电子总数与最外层电子数之比为4:3
②D原子最外层电子数与次外层电子数之比为3:4
③E-,C+,A+的离子半径逐渐减小
④A单质在E单质中燃烧火焰呈苍白色
请回答下列问题:
(1)E的最高价氧化物对应水化物的化学式为:______.它的酸性比D的最高价氧化物对应水化物的酸性:______.(填“强”或“弱”)
(2)X、Y是由上述元素中任意3种组成的强电解质,且构成的原子个数比均为1:1:1.已知X溶液中水电离出来的c(H+)=10-12mol/L,则X的电子式为:______;Y的水溶液酸碱性与X相同,则其原因是(写离子方程式):______;
(3)B与C构成原子个数比为1:1的化合物与H2O反应的化学方程式为:______;
(4)A与B,A与D均可形成18个电子的分子,这两种分子在水溶液中反应生成物之一是含10电子的化合物;该反应可观察到现象是:______,原因是(用化学方程式表示)______.
参考答案:A、B、C、D、E原子序数依次递增的五种短周期元素,已知:
①B原子核外电子总数与最外层电子数之比为4:3,根据核外电子排布可知,B原子最外层电子数只能为6,则核外电子总数为8,故B为O元素;
②D原子最外层电子数与次外层电子数之比为3:4,D原子只能有3个电子层,最外层电子数为6,则D为S元素;
③结合E-、C+、A+离子的电荷可知,E处于ⅦA族,C、A处于ⅠA族,由原子序数可知,C为Na;而E-、C+、A+半径逐渐减小,故E为Cl;
④A单质在E单质中燃烧火焰呈苍白色,可推知A为H元素,
(1)E为Cl,其最高价氧化物对应水化物的化学式为:H来源:91exam .orgClO4,非金属性Cl>S,故酸性HClO4>H2SO4,
故答案为:HClO4;强;
(2)X、Y是由上述元素中任意3种组成的强电解质,且构成的原子个数比均为1:1:1.已知X溶液中水电离出来的c(H+)=10-12mol/L,则X抑制水的电离,为酸或碱,则X为NaOH,其电子式为: ;Y的水溶液酸碱性与X相同,为碱性,Y为NaClO,其呈碱性原因是:ClO-+H2O?HClO+OH-,
;Y的水溶液酸碱性与X相同,为碱性,Y为NaClO,其呈碱性原因是:ClO-+H2O?HClO+OH-,
故答案为: ;ClO-+H2O?HClO+OH-;
;ClO-+H2O?HClO+OH-;
(3)O与Na构成原子个数比为1:1的化合物为Na2O2,与H2O反应生成NaOH与O2,反应化学方程式为:2Na2O2+2H2O=4NaOH+O2↑,
故答案为:2Na2O2+2H2O=4NaOH+O2↑;
(4)A与B、A与D均可形成18个电子的分子,分别为H2O2与H2S,H2O2具有强氧化性,与H2S反应生成S与H2O,反应方程式为:H2O2+H2S=S↓+2H2O,可以观察到:有淡黄色沉淀生成,
故答案为:有淡黄色沉淀生成;H2O2+H2S=S↓+2H2O.
本题解析:
本题难度:简单
2、选择题 有关化学用语正确的是
[? ]
A.乙烯的结构简式CH2CH2
B.乙醇的结构简式C2H6O
C.四氯化碳的电子式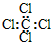
D.乙酸的分子式C2H4O2
参考答案:D
本题解析:
本题难度:简单
3、选择题 美、德两国科学家日前成功合成出具有独特化学性质的氢铝化合物(AlH3)n其结构类似由硼和氢组成的硼烷,有关研究报告发表在最新出版的美国《科学》杂志上。最简单的氢铝化合物为Al2H6,它的熔点为
150℃,燃烧热极高。Al2H6球棍模型如图。下列说法肯定不正确的是
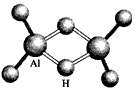
[? ]
A.氢铝化合物可能成为未来的火箭燃料
B.Al2H6在空气中完全燃烧,产物为氧化铝和水
C.Al2H6是离子化合物
D.Al2H6是非极性分子
参考答案:C
本题解析:
本题难度:一般
4、填空题 物质的结构是决定物质性质的重要因素。请回答下列问题:
(1)基态Ni原子核外电子排布式为____________;第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是_________________。
(2)NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分为0.069nm和0.078nm,则熔点NiO_____________FeO(填“<”或“>”);NiO晶胞中Ni2+的配位数为____________。
(3)肼可用作火箭燃料,燃烧时发生的反应是:N2O4+2N2H4=3N2+4H2O,若该反应中有4molN—H键断裂,形成的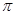 键有________mol。
键有________mol。
参考答案:(8分)(1)1s22s22p63s23p63d84s2(2分);C(碳)(2分) (2)>(1分) 6(1分)(3)3(2分)
本题解析:(1)Ni的原子序数为28,根据构造原理和能量最低原理可写出电子排布式为1s22s22p63s23p63d84s2。第二周期有2个未成对电子的元素是C和O元素,非金属性越强,电负性越大。碳元素的非金属性弱于氧元素,因此电负性较小的是C元素。
(2)Ni2+和Fe2+的离子半径分别为69pm和78pm,离子半径越小,离子键作用力越大,晶体的熔沸点越高,所以熔点NiO>FeO。NaCl中钠离子和氯离子的配位数分别为6,NiO的晶体结构类型与氯化钠的相同,NiO晶胞中Ni和O的配位数分别为6。
(3)单键都是 键,双键都是由1个
键,双键都是由1个 键和1个
键和1个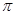 键构成的,而三键是由1个
键构成的,而三键是由1个 键和2个
键和2个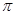 键构成的。氮气是由三键构成的,所以1mol氮气分子中含有2mol
键构成的。氮气是由三键构成的,所以1mol氮气分子中含有2mol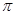 键。若该反应中有4molN-H键断裂,即有1mol肼参加反应,则生成1.5mol氮气,所以形成的
键。若该反应中有4molN-H键断裂,即有1mol肼参加反应,则生成1.5mol氮气,所以形成的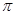 键有1.5mol×3=3mol。
键有1.5mol×3=3mol。
本题难度:一般
5、选择题 下列各元素的原子在形成不同物质时,既能形成非极性键,也能形成极性键,还能形成离子键的是
[? ]
A.Na?
B.Cl?
C.O?
D.Ar
参考答案:BC
本题解析:
本题难度:简单