1、填空题 (12分)【选做题】本题包括A、B两小题,请选定其中一小题,并在相应的答题区域内作答。若多做,则按A小题评分。
A.[物质结构与性质]
元素X基态原子的p电子比s电子少1个。元素Y基态原子的2p电子是2s电子的2倍。元素Z的一种单质为自然界硬度最大的物质。元素M位于第四周期,其基态原子失去3个电子后3d轨道半满。
(1)X、Y、Z的基态原子,第一电离能由大到小的顺序是?。
(2)X的氢化物易于液化,其原因是?。
(3)X与M形成的一种化合物晶胞结构如图所示。
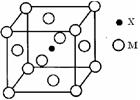
①每个晶胞中M离子的数目为?;
②该化合物的化学式为?。
(4)Y可形成单质Y3
①Y3分子的空间构型为?(用文字描述)。
②写出一种与Y3互为等电子体的分子的化学式:?。
(5)Y、Z的化合物ZY可与M的单质生成配合物M(ZY)5,该配合物中σ键与π键的个数比为?。
参考答案:(1)N>O>C (2分)(2)氨分子间形成氢键 (2分)(3)①4 ②Fe4N (各1分)
(4)①V型(或折线型) (2分)②SO2?(2分)(5)1∶1 (2分)
本题解析:元素X基态原子的p电子比s电子少1个,则电子排布为1s22s22p3,为N元素;元素Y基态原子的2p电子是2s电子的2倍,则2p轨道排布4个电子,为O元素;元素Z的一种单质为自然界硬度最大的物质,则元素Z为C元素;元素M位于第四周期,其基态原子失去3个电子后3d轨道半满,则M基态原子3 d轨道排布6个电子,为Fe元素。
(1)N元素2p轨道排布3个电子,为稳定状态,所以第一电离能由大到小顺序为:N>O>C
(2)N原子半径小,电负性大,氨分子间容易形成氢键,所以NH3易液化。
(3)①M位于8个顶点和6个面心,根据均摊法,每个晶胞含Fe:8×1/8+6×1/2=4。
②N原子位于晶胞中心,含有1个N原子,所以化学式为:Fe4N
(4)①O3中心O原子形成了2个O-O键,含有2对孤对电子,为sp3杂化,所以空间构型为V型(或折线型)。
②含有原子数和价电子数相等的微粒为等电子体,与O3互为等电子体的分子的化学式为SO2
(5)配合物M(ZY)5,为Fe(CO)5,含有5个σ键和5个π键,所以该配合物中σ键与π键的个数比为1:1。
本题难度:一般
2、填空题 (11分)下表是元素周期表的一部分, 针对表中的①~⑩种元素,填写下列空白:(无特殊说明均填元素符号、化学式等化学用语)
主族
周期
| IA
| ⅡA
| IIIA
| ⅣA
| ⅤA
| ⅥA
| ⅦA
| 0族
|
1
| ①
| ?
| ?
| ?
| ?
| ?
| ?
| ?
|
2
| ?
| ?
| ?
| ?
| ②
| ③
| ?
| ④
|
3
| ⑤
| ⑥
| ⑦
| ?
| ?
| ⑧
| ⑨
| ?
|
4
| ⑩
| ?
| ?
| ?
| ?
| ?
| ?
| ?
|
(1)在这些元素中,化学性质最不活泼的元素名称是?,最高价氧化物对应的水化物是两性氢氧化物的元素是?,⑤⑥⑩元素中原子半径最大的元素为?。⑧号元素的原子结构示意图为?。
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是?,碱性最强的化合物的化学式是?,⑧、⑨号元素的氢化物中还原性较强的是?。
(3)②与③形成的化合物属于?(填“共价”或“离子”)化合物。
(4)⑩号元素与水反应的化学方程式为?。
参考答案:氖 , Al ,K?各1分? ?(2分)?
?(2分)?
(2) HClO4、KOH、 H2S(各1分)
(3) 共价 (1分)?(4)2K+2H2O==2KOH+H2 ↑? (2分)
本题解析:考查元素周期表的结构和元素周期律的应用。根据元素在周期表中的位置可判断,①~⑩分别为H、N、O、Ne、Na、Mg、Al、S、Cl、K。同周期自左向右原子半径逐渐减小,金属性逐渐减弱,非金属性逐渐增强。同主族自上而下原子半径逐渐增大,金属性逐渐增强,非金属性逐渐减弱,所以原子半径是K>Na>Mg。非金属性越强,相应氢化物的还原性就越弱,所以硫化氢的还原性大于氯化氢的。N和O都是非金属,形成的化学键是极性键。钾的金属性很强,与水反应剧烈,生成氢氧化钾和氢气。
本题难度:一般
3、选择题 美国科学家用某有机分子和球形笼状分子C60制成了“纳米车”,每辆“纳米车”是由一个有机分子和4个C60分子构成。“纳米车”可以用来运输单个的有机分子。下列说法正确的是
A.人们用肉眼可以清晰看到“纳米车”的运动
B.C60分子内只存在共价键
C.C60是一种新型的化合物
D.C60与金刚石互为同位素
参考答案:B
本题解析:
正确答案:B
A.不正确,人们无法用肉眼可以清晰看到“纳米车”的运动,其大小约10-9m;
B.正确,C60分子内只存在C-C、C=C共价键
C.不正确,C60组成元素只有一种,是单质;
D.不正确,C60与金刚石是由碳元素组成的两种不同的单质,互为同素异形体。
本题难度:简单
4、填空题 (15分)C、Si、S和N元素在化学中占有极其重要的地位。
 (1)写出Si的基态原子价电子排布式 ?。
(1)写出Si的基态原子价电子排布式 ?。
从电负性角度分析,C、Si和O元素的非金属活泼性由强至弱的顺序为 。
 (2)SiC的晶体结构与晶体硅的相似,其中C原子的杂化方式为 ?,微粒间存在的作用力是 ?。
(2)SiC的晶体结构与晶体硅的相似,其中C原子的杂化方式为 ?,微粒间存在的作用力是 ?。
(3)氧化物MO的电子总数与SiC的相等,MO是优良的耐高温材料,其晶体结构与NaCl晶体相似。MO的熔点比CaO的高,其原因是 ?。
 (4)SO2、NO2、H2S同属于?结构(填“三角锥形”、“直线型”或“V字型”)。从微观结构角度分析,其中一种分子又与另二种分子有不同之处,该分子的化学式是?。
(4)SO2、NO2、H2S同属于?结构(填“三角锥形”、“直线型”或“V字型”)。从微观结构角度分析,其中一种分子又与另二种分子有不同之处,该分子的化学式是?。
参考答案::(1) 3s23p2(2分)?O>C>Si (2分)
(2)? sp3(2分)?共价键(2分)
(3) Mg2+半径比Ca2+小,MgO晶格能大(3分)
(4) V字型(2分)? H2S(2分)
本题解析::电负性同周期从前往后增加,从上至下减小,O>C>Si SiC的晶体结构与晶体硅的相似,都是原子晶体,C原子的杂化方式为sp3,微粒间存在的作用力是?共价键。离子晶体的晶格能越大,离子键越强,晶格能与原子半径成反比,与电荷数成正比。MgO的熔点比CaO的高,其原因是Mg2+半径比Ca2+小,MgO晶格能大. SO2、NO2、H2S是分子晶体,分子结构为V字型。H2S有2对孤电子,和其他两种不一样。
本题难度:一般
5、选择题 日本9级强震引起的核泄漏,放射性物质有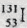 ,下列有关
,下列有关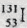 的叙述中错误的是(?)
的叙述中错误的是(?)
A.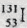 的化学性质与
的化学性质与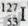 相同
相同
B.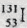 的原子序数为53
的原子序数为53
C.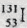 的原子核外电子数为78
的原子核外电子数为78
D.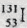 的原子核内中子数多于质子数
的原子核内中子数多于质子数
参考答案:C
本题解析:考查原子的组成及表示方法。在表示原子组成时元素符号的左下角表示质子数,左上角表示质量数。由于质子数和中子数之和是质量数,所以该原子的中子数是131-53=78。A中的两种微粒属于同位素,质子数等于核外电子数,所以错误的选项是C。答案选C。
本题难度:一般