1、选择题 下列说法正确的是( )
A.第ⅠA族元素的金属性一定比第ⅡA族元素的金属性强
B.第ⅥA族元素中氢化物最稳定的其沸点一定最高
C.全部由非金属元素形成的化合物中只有共价化合物
D.短周期中,同周期元素的离子半径从左到右逐渐减小
2、填空题 A、B、C、D、E、F均为短周期元素;A、C具有相同的电子层数;E元素在B的下一周期;A与D同主族;原子半径大小为F>E>A>B>C。AC2常温下呈气态,通入紫色的石蕊溶液中会变红色,单质E可以在AC2中燃烧,发生置换反应。回答:
(1)AC2的分子构型为?,E在AC2中燃烧的化学方程式为?。
(2)A、D的最高价氧化物熔点更高是?(填物质化学式),其理由是?
??。
(3)B、C、E、F均能形成简单 离子,其半径由大到小的顺序为?。(用离子符号表示)
离子,其半径由大到小的顺序为?。(用离子符号表示)
(4)F3B是一种离子化合物,能与水反应生成两种碱性物质。将F3B加入到足量的盐酸中,写出发生反应的离子方程式?。
(5)A、E两元素形成阴、阳离子质量比为1∶1的离子化合物能与水反应生成一种气体,此气体的结构式为?。
3、填空题 某同学做元素性质递变规律实验时,设计了一套实验方案,记录了有关实验现象。
实验步骤
| 实验现象(与步骤未对应)
|
① 将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液
| A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色
|
②将一小块金属钠放入滴有酚酞溶液的冷水中
| B.有气体产生,溶液变成浅红色
|
③将镁条投入稀盐酸中
| C.反应不十分剧烈;产生无色气体
|
④将铝条投入稀盐酸中
| D.剧烈反应,迅速产生大量无色气体
|
请帮助该同学整理并完成实验报告。
(1)实验目的:研究?元素性质递变规律。
(2 )实验内容:(填写与实验步骤对应的实验现象的编号)
(3)写出实验①②对应化学方程式
实验① ?,
实验②?。
(4)实验结论:? ? ? ?。
4、选择题 简单原子的原子结构可用下图表示方法形象表示:
其中●表示质子或电子,○表示中子,则下列有关①②③的叙述正确的是(?)
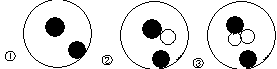
A.①②③互为同位素
B.①②③是同种元素的三种同位素
C.①②③是三种化学性质不同的微粒
D.①②③具有相同的质量数
5、选择题 X、Y、Z、W是短周期元素,X元素原子的最外层未达到8电子稳定结构,工业上通过分离液态空气获得其单质;Y元素原子最外电子层上s、p电子数相等;Z元素+2价阳离子的核外电子排布与氖原子相同;W元素原子的M层有1个未成对的p电子。下列有关这些元素性质的说法一定正确的是(?)
A.X元素的氢化物的水溶液显碱性
B.Z元素的离子半径大于W元素的离子半径
C.Z元素的单质在一定条件下能与X元素的单质反应
D.Y元素最高价氧化物的晶体具有很高的熔点和沸点