1、选择题 X、Y、Z、W有如右图所示的转化关系,则X、W可能是( )
 ?
?
①C.O2?②AlCl3、NaOH? ③NaOH、CO2?④S、O2
A.①②③? B.①②? C.③④? D.①②③④
参考答案:A
本题解析:略
本题难度:一般
2、简答题 如图,A到L为常见物质或该物质的水溶液,B在A气体中燃烧产生棕黄色烟,B、G为中学化学中常见金属单质,I的焰色反应为黄色,组成J的元素原子核内只有一个质子,F为无色、有刺激性气味气体,且能使品红溶液褪色.
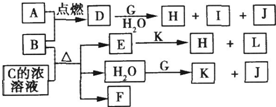
回答下列问题:
(1)K名称为______,所含的化学键有______.
(2)①D的水溶液呈棕黄色,则D的水溶液与G反应的离子方程式为______.
②少量B与C的浓溶液加热时反应的化学方程式为______
(3)①若将F通入一定量K的水溶液中,则所得溶液中各离子浓度一定满足的下列关系式为______(填代号).
A.c(Na+)+c(H+)=c(OH-)+c(HSO3-)+2c(SO32-)
B.2c(Na+)=3c(H2SO3)+3c(HSO3-)+3c(SO32-)
C.c(Na+)>c(HSO3-)>c(SO32-)>c(H2SO3)
D.c(OH-)>c(H+)
②若将标准状况下2.24L的F通入150mL1mol?L-1的K溶液中.则所得溶液中各粒子浓度关系满足的上述关系式为______(填代号).
参考答案:由J的元素原子核内只有一个质子知J为H2;I的焰色反应为黄色,所以I含Na元素;由金属B在A气体中燃烧产生棕黄色烟可知A为Cl2,B为Fe或Cu,则D为FeCl3或CuCl2,;
且D+G+H2O→H+I+J,结合I含Na元素知G为金属钠,且H2O+G→K+J(H2),所以K为NaOH,D的水溶液呈棕黄色,则D为FeCl3,其水溶液与Na的反应为:6Na+2FeCl3+6H2O═2Fe(OH)3↓+6NaCl+3H2↑,F为无色、有刺激性气味气体,且能使品红溶液褪色,应为SO2,则C为H2SO4,E为Fe2(SO4)3,H为Fe(OH)3,L为NaCl,
(1)由以上分析可知,K为NaOH,名称为氢氧化钠;所含化学键为离子键和共价键;故答案为:氢氧化钠;离子键、共价键;
(2))①D的水溶液呈棕黄色,D为FeCl3,在氯化铁溶液中加入金属钠,钠先和水反应生成氢氧化钠和氢气,氢氧化钠和氯化铁反应生成氢氧化铁沉淀,则FeCl3的水溶液与Na反应的离子方程式为:Fe3++6H2O+6Na=2Fe(OH)3↓+6Na++3H2↑或2Na+2H2O═2Na++2OH-+H2↑,Fe3++3OH-=Fe(OH)3↓,
故答案为:2Fe3++6H2O+6Na=2Fe(OH)3↓+6Na++3H2↑或2Na+2H2O═2Na++2OH-+H2↑,Fe3++3OH-=Fe(OH)3↓;
②少量B为Fe与C为H2SO4,少量铁在与浓硫酸在加热条件下反应生成硫酸铁和二氧化硫和水,反应的化学方程式为:2Fe+6H2SO4(浓)?△?.?Fe2(SO4)3+3SO2↑+6H2O;
故答案为:2Fe+6H2SO4(浓)?△?.?Fe2(SO4)3+3SO2↑+6H2O;
(3)①若将F为SO2通入一定量K为NaOH的水溶液中,反应生成亚硫酸钠溶液,或亚硫酸氢钠溶液,或二者混合物,则所得溶液中各离子浓度一定满足的下列关系式为:
A.溶液中一定存在电荷守恒:c(Na+)+c(H+)=c(OH-)+c(HSO3-)+2c(SO32-);溶液中一定存在电荷守恒,故A一定;
B.2c(Na+)=3c(H2SO3)+3c(HSO3-)+3c(SO32-),生成的盐溶液是Na2SO3时物料守恒为c(Na+)=2c(H2SO3)+2c(HSO3-)+2c(SO32-),若是NaHSO3溶液存在物料守恒为:.c(Na+)=c(H2SO3)+c(HSO3-)+c(SO32-),若是Na2SO3和NaHSO3的混合溶液,存在的物料守恒为:2c(Na+)=3c(H2SO3)+3c(HSO3-)+3c(SO32-);故B不一定;
C.c(Na+)>c(HSO3-)>c(SO32-)>c(H2SO3),离子浓度大小是硫酸氢钠溶液中的离子浓度大小,若生成的是亚硫酸钠溶液时,离子浓度大小为:c(Na+)>c(SO32-)>c(HSO3-)>c(H2SO3),故C不一定;
D.c(OH-)>c(H+)溶液中生成的盐溶液是Na2SO3,强碱弱酸盐水解显碱性,c(OH-)>c(H+);若是NaHSO3,溶液中亚硫酸根离子电离程度大于亚硫酸氢根离子的水解,溶液呈酸性,c(OH-)<c(H+),故D不一定;
故答案为:A.
②若将标准状况下2.24L的SO2通入150mL1mol?L-1的NaOH溶液中.n(SO2)=0.1 mol;n(NaOH)=0.15mol;n(SO2):n(NaOH)=2:3,反应后生成了亚硫酸钠和亚硫酸氢钠的混合溶液,反应的化学方程式为:2SO2+3NaOH=Na2SO3+NaHSO3+H2O;则所得溶液中各粒子浓度关系满足的上述关系式:
A、一定符合溶液中的电荷守恒,故A符合;
B、Na2SO3和NaHSO3的混合溶液,存在的物料守恒为:2c(Na+)=3c(H2SO3)+3c(HSO3-)+3c(SO32-);故B符合;
C、反应得到的是同浓度的亚硫酸钠和亚硫酸氢钠的混合溶液,溶液中亚硫酸氢根离子电极程度大于亚硫酸根离子水解程度,故溶液显酸性,溶液中离子浓度大小为c(Na+)>c(SO32-)>c(HSO3-)>c(H2SO3),故C不符合;
D、反应得到的是同浓度的亚硫酸钠和亚硫酸氢钠的混合溶液,溶液中亚硫酸氢根离子电极程度大于亚硫酸根离子水解程度,故溶液显酸性,c(OH-)<c(H+),故D不符合;
故答案为:AB.
本题解析:
本题难度:一般
3、填空题 如图是某元素及其重要化合物之间的相互转化关系图(生成物中不含该元素的物质均已略去).其中A是单质,D在常温下呈气态,F可用作氮肥.
据此,请回答下列问题:
(1)写出以下物质的化学式:A______,D______,F______.
(2)写出下列变化的化学方程式:
B→C______.
E→C______.
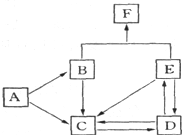
参考答案:某元素及其重要化合物之间的相互转化关系图(生成物中不含该元素的物质均已略去),F可用作氮肥,则F为铵盐,且这几种物质中都含有相同元素,A是单质,A能转化为B和C,B和E反应生成铵盐,且都含有相同元素,则A是N2,B是NH3,氮气和氧气反应生成NO,所以C是NO,D在常温下呈气态,一氧化氮和氧气反应生成D,则D为NO2,二元化氮和水反应生成硝酸和一氧化氮,硝酸被还原生成二氧化氮,所以E是HNO3,F是NH4NO3,
(1)通过以上分析知,A、D、F分别是N2、NO2、NH4NO3,
故答案为:N2;NO2;NH4NO3;
(2)B是NH3,C是NO,氨气被催化氧化生成一氧化氮和水,反应方程式为:4NH3+5O2催化剂.△4NO+6H2O,
E是HNO3,铜和稀硝酸反应生成一氧化氮,反应方程式为:3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O,
故答案为:4NH3+5O2催化剂.△4NO+6H2O;3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O.
本题解析:
本题难度:一般
4、填空题 (10分)下图是一些常见的单质和化合物之间的转化关系图,有些反应中的部分物质被略去。常温常压下,A为无色有毒气体,B为红棕色粉末,C、E为生活中最常用的金属单质,J为红褐色固体,L为两性氢氧化物。反应①、②均为工业上的重要反应。

请回答下列问题:
⑴写出B的化学式为?;D的电子式为?。
⑵组成单质C的元素在元素周期表中的位置为?;
⑶写出向I溶液中加入过量NaOH溶液时发生反应的离子方程式:?
?。
⑷写出向Na2SiO3溶液中通入少量D时发生反应的离子方程式:?
?。
参考答案:
本题解析:略
本题难度:一般
5、选择题 下图各物质是中学化学中常见的物质,甲和A的焰色反应为黄色,常温常压下B为无色无味气体,丁可使带火星的木条复燃。请回答下列问题:
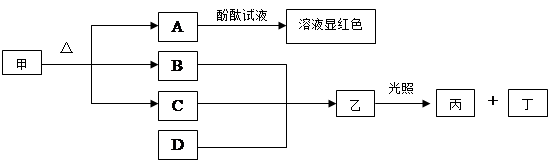
⑴写出B的电子式?。
⑵工业上生产D采用石灰乳与某种气体反应。D常用作?剂
⑶写出由A变甲的化学方程式?。
⑷B与甲烷在一定条件下生成氢气和CO的化学方程式?。
参考答案:(6分)
(1) (1分)
(1分)
(2)漂白或消毒(1分)
(3)CO2+Na2CO3+H2O=2NaHCO3(其他合理答案均给分)
(4)CO2+CH4=2CO+2H2(2分)
本题解析:丁可使带火星的木条复燃,应为O2,结合乙在光照条件下分解的性质可知乙为HClO,丙为HCl,甲和A的焰色反应为黄色,说明都含有Na元素,且A的水溶液呈碱性,可说明甲为NaHCO3,A为Na2CO3,则B为CO2,C为H2O,工业上生产D采用石灰乳与某种气体反应,结合题给转化关系可知D应为Ca(ClO)2,
(1)由以上分析可知B为CO2,电子式为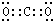 ,故答案为:
,故答案为: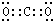 ;
;
(2)D为Ca(ClO)2,具有氧化性,可与酸反应生成具有漂白性的次氯酸,常用于漂白或消毒,
故答案为:漂白或消毒;
(3)Na2CO3可与CO2和水反应生成NaHCO3,反应的方程式为CO2+Na2CO3+H2O=2NaHCO3,
故答案为:CO2+Na2CO3+H2O=2NaHCO3;
(4)CO2与甲烷在一定条件下生成氢气和CO,二者发生氧化还原反应,反应的方程式为CO2+CH4=2CO+2H2,
故答案为:CO2+CH4=2CO+2H2.
本题难度:一般