1、选择题 下列物质属于电解质的是
A.Cu
B.硝酸钾溶液
C.AgCl
D.NH3
参考答案:C
本题解析:试题分析:在水溶液中或熔融状态下能够导电的化合物是电解质,A和B是单质或混合物,不是电解质,D项溶于水本身不能导电,其导电作用的是一水合氨,氨气是非电解质。
考点:考查电解质的概念
点评:属于简单题
本题难度:一般
2、选择题 下列离子能在水溶液中大量共存的一组是
A.Fe3+、HCO3ˉ、Clˉ、SCNˉ
B.Ba2+、NO3ˉ、SO32ˉ、H+
C.Mg2+、NH4+、Brˉ、OHˉ
D.Na+、Cu2+、SO42ˉ、Clˉ
参考答案:D
本题解析:试题分析:Fe3+与HCO3ˉ易发生双水解反应,生成Fe(OH)3沉淀和CO2气体,Fe3+与SCNˉ易发生复分解反应或显色反应,生成属于弱电解质的Fe(SCN)3,故A错误;SO32ˉ与Ba2+易反应生成BaSO3沉淀,SO32ˉ与H+易反应生成SO2气体和H2O,SO32ˉ还易与NO3ˉ、H+发生氧化还原反应,生成SO42ˉ、NO、H2O,故B错误;OHˉ易与Mg2+反应生成Mg(OH)2沉淀,OHˉ易与NH4+反应生成NH3、H2O,故C错误;Na+、Cu2+、SO42ˉ、Clˉ之间不能反应,故D正确。
考点:考查离子共存。
本题难度:困难
3、填空题 (10分)(1)写出下列物质在水溶液中的电离方程式
氢氧化钡
硫酸铁
(2)写出下列反应的离子方程式
硫酸钠和硝酸钡
碳酸钠与足量的盐酸
(3)实验室制备氢氧化铁胶体的方法是:向沸水中逐滴加入5-6滴饱和的三氯化铁溶液,?,停止加热。(请补充完整)
反应的化学方程式为?。
参考答案:(1)Ba(OH)2= Ba2+ +2OH- (2分)? Fe2(SO4)3=2Fe3+ + 3SO42- (2分)
(2)SO42- + Ba2+ =BaSO4(2分)?CO32- + 2H+ = CO2↑ + H2O (2分)
(3)继续煮沸至红褐色(1分)? FeCl3? +3 H2O =? Fe(OH)3(胶体) +? 3HCl(1分)
本题解析:(1)考查电离方程式的书写,氢氧化钡和硫酸铁都是易溶的,所以电离方程式分别是Ba(OH)2= Ba2+ +2OH-、Fe2(SO4)3=2Fe3+ + 3SO42-。
(2)考查离子方程式的书写的。
(3)考查氢氧化铁胶体的制备。
本题难度:简单
4、选择题 下列离子方程式正确的是
A.Cl2与NaOH溶液反应:Cl2+2OH-=Cl-+ClO-+H2O
B.Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O
C.碳酸镁中滴加稀盐酸:CO32-+2H+=CO2↑+H2O
D.氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-=BaSO4↓+H2O
参考答案:A
本题解析:
分析:A、氯气和氢氧化钠溶液反应生成氯化钠和次氯酸钠;
B、三价铁离子具有氧化性,能够氧化碘离子;
C、碳酸镁不能拆开,应该写成化学式;
D、方程式中氢离子和氢氧根离子计算量错误.
解答:A、氯气和氢氧化钠溶液反应的离子方程式是:Cl2+2OH-=Cl-+ClO-+H2O,故A正确;
B、Fe(OH)3溶于氢碘酸,生成的三价铁离子具有氧化性,正确的离子方程式是,2I-+2Fe(OH)3+6H+=2Fe2++6H2O+I2,故B错误;
C、碳酸镁应该写成化学式,正确的离子方程式是:MgCO3+2H+=CO2↑+H2O+Mg2+,故C错误;
D、钡离子和氢氧根离子、硫酸根离子和氢离子计量数配比错误,正确的离子方程式是:Ba2++SO42-+2H++2OH-=BaSO4↓+2H2O,故D错误;
故选A.
点评:本题考查了离子方程式的书写,注意D项中的物质中离子配比,本题难度不大.
本题难度:简单
5、填空题 某无色溶液X,由Na+、Ag+、Ba2+、Al3+、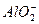 、
、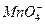 、
、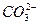 、
、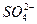 中的若干种离子组成,取溶液进行如下连续实验:
中的若干种离子组成,取溶液进行如下连续实验:
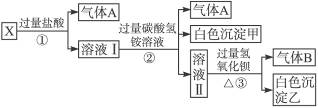
(1)气体A的成分是______________,气体B的成分是_______________。(填化学式)
(2)X溶液中一定存在的离子是_______________。
(3)写出步骤①中发生反应的所有的离子方程式_______________。
(4)写出步骤②中形成白色沉淀甲的离子方程式_______________。
(5)通过上述实验,白色沉淀乙的组成可能是_______________;只要设计一个简单的后续实验就可以确定该沉淀的组成,该方法是______________________________。
参考答案:(1)CO2NH3
(2)Na+、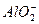 、
、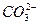
(3)C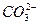 +2H+====CO2↑+H2O
+2H+====CO2↑+H2O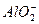 +4H+====Al3++2H2O
+4H+====Al3++2H2O
(4)Al3++3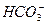 ====Al(OH)3↓+3CO2↑
====Al(OH)3↓+3CO2↑
(5)BaCO3或BaCO3、BaSO4的混合物在沉淀乙中加足量的稀盐酸,若全部溶解则说明只有BaCO3,若不能全部溶解,说明是BaCO3和BaSO4的混合物
本题解析:由溶液是无色的排除了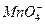 的干扰,能和盐酸反应生成气体的是
的干扰,能和盐酸反应生成气体的是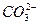 ,
,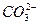 的存在排除了Ag+、Ba2+、Al3+,所以原溶液中含有的阳离子只能是Na+。与碳酸氢铵溶液反应生成白色沉淀的离子只能是Al3+(由原溶液中的
的存在排除了Ag+、Ba2+、Al3+,所以原溶液中含有的阳离子只能是Na+。与碳酸氢铵溶液反应生成白色沉淀的离子只能是Al3+(由原溶液中的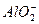 与过量的盐酸反应而得),所以原溶液中含有
与过量的盐酸反应而得),所以原溶液中含有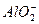 ,沉淀甲只能为Al(OH)3,发生步骤①的反应为:
,沉淀甲只能为Al(OH)3,发生步骤①的反应为: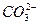 +2H+====CO2↑+H2O和
+2H+====CO2↑+H2O和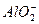 +4H+====Al3++2H2O;步骤②时形成白色沉淀甲的离子方程式为Al3++3
+4H+====Al3++2H2O;步骤②时形成白色沉淀甲的离子方程式为Al3++3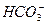 ====Al(OH)3↓+3CO2↑;过量的Ba(OH)2提供了大量的OH-和Ba2+,所以气体B为NH3,白色沉淀乙可能是BaCO3或BaCO3、BaSO4的混合物,不好确定,检验方法为在沉淀乙中加足量的稀盐酸,若全部溶解则说明只有BaCO3,若不能全部溶解,说明是BaCO3和BaSO4的混合物。
====Al(OH)3↓+3CO2↑;过量的Ba(OH)2提供了大量的OH-和Ba2+,所以气体B为NH3,白色沉淀乙可能是BaCO3或BaCO3、BaSO4的混合物,不好确定,检验方法为在沉淀乙中加足量的稀盐酸,若全部溶解则说明只有BaCO3,若不能全部溶解,说明是BaCO3和BaSO4的混合物。
本题难度:简单