1、选择题 铜片和锌片用导线连接后插入稀硫酸中,锌片是
[? ]
A.阴极
B.正极
C.阳极
D.负极
参考答案:D
本题解析:
本题难度:简单
2、填空题 (2008淄博一模,16)铝的阳极氧化,是一种常用的金属表面处理技术,它能使铝的表面生成一层致密的氧化膜,该氧化膜不溶于稀硫酸。某化学研究小组在实验室中按下列步骤模拟该生产过程。填写下列空白:

(1)配制实验用的溶液。要配制200mL密度为1.2g·cm-3的溶质质量分数为16%
的NaOH溶液,需要称取?gNaOH固体。
(2)把铝片浸入热的16%NaOH溶液中约半分钟左右洗去油污,除去表面的氧化膜,取出用水冲洗。写出除去氧化膜的离子方程式?。
(3)如图,组装好仪器,接通开关K,通电约25min。在阳极生成氧化铝,阴极产生气体。写出该过程中的电极反应式:
阳极?
阴极?
(4)断开电路,取出铝片,用1%稀氨水中和表面的酸液,再用水冲洗干净。写出该过程发生反应的离子方程式?
参考答案:(1)38.4? (2)Al2O3+2OH-+3H2O=2[A1(OH)4]-或Al2O3+2OH-=2AlO2-+H2O (3)2Al+3H2O→Al2O3+6H++6e—? 6H++6e—→3H2↑ ?(4)NH3·H2O+H+= NH4++H2O
本题解析:本题考查溶液配制的计算、离子方程式和电解方程式的书写,中等题。(1)根据m(溶质)=ρ(溶液)×V(溶液)×W%计算;(2)该反应为NaOH与Al2O3的反应;(3)阳极为Al放电,产物为Al2O3;阴极为H+放电,产物为H2。(4)为氨水和硫酸的反应。
本题难度:一般
3、简答题 下列关于原电池的叙述中,错误的是( )
A.原电池是将化学能转化为电能的装置
B.用导线连接的两种不同金属同时插入液体中,就能形成原电池
C.在原电池中,导线上(外电路)电子导电,溶液中(内电路)离子导电
D.在原电池中,电子流出的一极是负极,发生氧化反应
参考答案:A、原电池是把化学能转变为电能的装置,故A正确.
B、用导线连接的两种不同金属同时插入电解质溶液中,且负极和电解质溶液必须能自发的进行氧化还原反应才能形成原电池,故B错误.
C、在原电池中,外电路上电子定向移动,内电路上阴离子向负极移动,阳离子向正极移动,所以就形成了闭合回路产生了电流,故C正确.
D、在原电池中,负极上失电子发生氧化反应,正极上得电子发生还原反应,所以电子从负极流出沿导线流向正极,故D正确.
故选B.
本题解析:
本题难度:一般
4、填空题 (8分)
如图所示,是原电池的装置图( 为电流表)。请回答:
为电流表)。请回答:
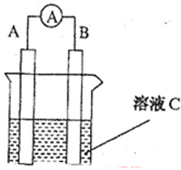
(1)若C为稀H2SO4溶液,电流表指针发生偏转,B电极材料为Fe且做负极,则A电极上发生的电极反应式为?;反应进行一段时间后溶液C的pH将?(填“升高”“降低”或“基本不变”)。
(2)若需将反应:Cu+2Fe3+=Cu2++2Fe2+设计成如上图所示的原电池装置,则A(负极)极材料为?,B(正极)极材料为?,溶液C为??。
(3)若C为NaOH溶液,A电极材料为Al,B电极材料为Mg,负极上发生的电极反式为?。
参考答案:(1)2H++2e-==H2↑;升高
(2)Cu?石墨(合理即可)? FeCl3溶液;
(3)Al-3e-+4OH-=AlO-2+2H2O.
本题解析:(1)铁作负极,则该原电池反应是铁与稀硫酸置换氢气的反应,所以正极反应是氢离子得电子生成氢气,电极反应式为2H++2e-==H2↑;溶液中氢离子放电,导致溶液中氢离子浓度减小,pH升高;
(2)Cu+2Fe3+=Cu2++2Fe2+设计成如上图所示的原电池装置,根据方程式中物质发生的反应类型判断,Cu发生氧化反应,作原电池的负极,所以A材料是Cu,B极材料是比Cu不活泼的导电物质如石墨、Ag等即可。溶液C中含有Fe3+,如FeCl3溶液;
(3)若C为NaOH溶液,A电极材料为Al,B电极材料为Mg,则Al与氢氧化钠溶液反应,则Al作负极,电极反应式为Al-3e-+4OH-=AlO-2+2H2O.
本题难度:一般
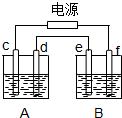
5、选择题 如图,A池用石墨电极电解NaOH溶液,B池精炼粗铜,一段时间后停止通电,A池中d极产生具有氧化性的气体在标准状况下为2.24L.下列说法正确的是( )
A.A池为电解池,B池为原电池
B.d、e两极都发生氧化反应
C.e极应为粗铜板材料
D.B池中e极质量增加12.8g