1、填空题 按要求完成下列原电池电极反应式或总反应的化学方程式。
(1)负极(Fe) ;正极(石墨)
电解质溶液(稀硫酸)总反应
(2)负极(Cu) ; 正极(石墨)
电解质溶液(FeCl3溶液)总反应
(3)用Fe和Cu作电极材料,以浓HNO3为电解质溶液构成的原电池,则负极的电极反应式为 ;总反应为
参考答案:(10分)(1、2小题每空1分,3小题每空2分)
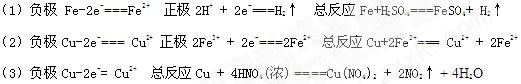
本题解析:略
本题难度:一般
2、选择题 汽车的启动电源常用铅蓄电池,放电时其电池反应如下:PbO2+Pb+2H2SO4="=" 2PbSO4+2H2O。根据此反应判断,下列叙述中正确的是
A.Pb是正极
B.PbO2得电子,被氧化
C.负极反应是Pb+SO42——2e—="=" PbSO4
D.电池放电时,溶液酸性增强
参考答案:C
本题解析:在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。根据反应式可知,铅失去电子,二氧化铅得到电子,所以铅是负极,二氧化铅是正极。选项C是错误的,答案选C。
本题难度:一般
3、选择题 我国拥有完全自主产权的氢氧燃料电池车在奥运会期间为运动员提供服务。某种氢氧燃料电池的电解液为KOH溶液。下列有关电池的叙述不正确的是
A.正极反应式为:O2+2H2O+4e- == 4OH-
B.用该电池电解CuCl2溶液,产生2.24LCl2(标况)时,有0.1mol电子转移
C.该燃料电池的总反应方程式为:2H2+O2==2H2O
D.工作一段时间后,电解液中的KOH的物质的量不变
参考答案:B
本题解析:氧气得到电子,在正极通入,A正确;标准状况下2.24L氯气的物质的量是0.1mol,转移电子的物质的量是0.1mol×2=0.2mol,B不正确;负极是氢气失去电子,因此总的反应式就是2H2+O2==2H2O,C正确;根据总的反应式可知,氢氧化钾的物质的量是不变的,但浓度是降低,D正确,答案选B。
考点:考查原电池的有关判断和计算等
点评:在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应,据此可以进行有关的判断和计算。
本题难度:困难
4、选择题 下列装置能构成原电池的是( )
A.
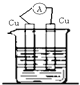
稀硫酸
B.
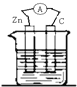
稀硫酸
C.
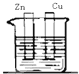
稀硫酸
D.
无水乙醇
参考答案:A.电极材料相同,不能形成原电池,故A错误;
B.形成原电池时,锌为负极,C为正极,符合原电池的组成条件,故B正确;
C.没有形成闭合回路,不能形成原电池,故C错误;
D.无水乙醇不导电,不能形成原电池,故D错误.
故选B.
本题解析:
本题难度:简单
5、选择题 如图所示,电流表G发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液。则A、B、C为

A.A是Zn,B是Cu,C是稀H2SO4
B.A是Cu,B是Zn,C是稀H2SO4
C.A是Fe,B是Ag,C是稀AgNO3溶液
D .A是Ag,B是Fe,C 是稀 AgNO3溶液
参考答案:D
本题解析:试题分析:若 A是Zn,B是Cu,C是稀H2SO4,则构成了锌铜原电池,A为负极,锌溶解,A逐渐变细,B极则不变,故A错误;若 A是Cu,B是Zn,C是稀H2SO4,则构成了锌铜原电池,B极不会逐渐变细,故B也错误;若A是Fe,B是Ag,C是稀AgNO3溶液,则构成铁银原电池,A溶解变细,B析出银变粗,故C错误;若 A是Ag,B是Fe,C 是稀 AgNO3溶液,则构成铁银原电池,而A极逐渐变粗,B极逐渐变细,故D正确,为本题的答案。
考点:原电池
点评:本题考查了原电池的基本知识,该考点是高考考查的重点和难点,本题有一定的综合性,难度中等。
本题难度:简单