1、填空题 (14分) 卤化物和卤酸盐在工业生产中有着重要的作用。某小组为探究其中一些盐的性质,查阅资料并进行实验。查阅资料如下:
① BrO3- + 6I- + 6H+ = 3I2 + Br-+ 3H?2O?② 2BrO3- + I2 = 2IO3- + Br2
③ IO3- + 5I- + 6H+ = 3I2 + 3H2O? ④ 2IO3- + 10Br-+ 12H+ = I2 + 5Br2 + 6H2O
实验如下:
步骤
| 现象
|
ⅰ.向盛有30 mL 0.2 mol·L-1 KI溶液的锥形瓶中依次滴入几滴淀粉溶液和足量稀硫酸,再用滴定管逐滴加入KBrO3溶液
| 随着KBrO3溶液滴入,溶液由无色变为蓝色并逐渐加深,最终保持不变
|
ⅱ.继续向上述溶液中滴入KBrO3溶液
| 溶液的蓝色逐渐褪去
|
请回答:
(1)步骤ⅰ开始时发生的反应如资料①所示,溶液中I-完全被氧化时转移?mol电子,该反应中硫酸表现出的化学性质是?。
(2)上述资料中的反应?(填序号)可表示步骤ⅱ中的反应,通过该反应?(填“能”或“不能”)说明碘的非金属性强于溴,原因是?。
(3)根据资料中的反应①~④并结合所学知识,判断IO3-、BrO3-、I2、Br2的氧化性由强到弱的顺序是?;KBrO3溶液与KBr溶液在酸性条件下反应的离子方程式是?。
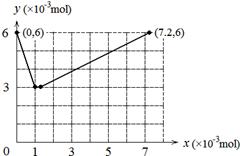
(4)若用y表示锥形瓶中含碘物质的物质的量,用x表示所滴入KBrO3的物质的量,在下图中画出上述整个实验过程中y随x的变化曲线(要求:在图中标出终点坐标)。
参考答案:(1)0.006?酸性?(2)②?不能?该反应只能说明I2的还原性比Br2强
(3)BrO3-> IO3-> Br2 > I2?BrO3-+ 5Br- + 6H+ = 3Br2 + 3H2O
(4)?
本题解析:(1)I-被氧化成I2,0.006mol I-被氧化时转移电子数为0.006mol。硫酸表现出的是酸性作用。
(2)ii是KBrO3氧化I2,所以②反应符合。该反应只能说明I2的还原性比Br2强,不能说明碘的非金属性强于溴。
(3)根据氧化剂的氧化性强于氧化产物的氧化性可知氧化性BrO3-> IO3-> Br2 > I2。KBrO3溶液与KBr溶液在酸性条件下反应的离子方程式是BrO3-+ 5Br- + 6H+ = 3Br2 + 3H2O。
(4)整个过程发生如下两个反应:①BrO3-+ 6I-+ 6H+ = 3I2 + Br-+ 3H?2O ②2BrO3-+ I2 = 2IO3-+ Br2,当
KBrO3加入1×10-3mol时I-全部被氧化成I2,当KBrO3加入7×10-3mol时I2全部被氧化成IO3-。所以图像为 。
。
点评:本题主要根据实验的现象来确定反应。
本题难度:困难
2、选择题 KOH是我国古代纺织业常用的洗涤剂,古代制取KOH的流程如图,在上述流程中没有涉及的化学反应类型是
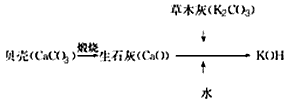
[? ]
A.化合反应
B.分解反应
C.复分解反应
D.置换反应
参考答案:D
本题解析:
本题难度:简单
3、填空题 (6分)某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2。已知该反应中,H2O2只发生如下过程:H2O2→O2。
(1)该物质H2O2在反应中表现出?(填写编号)。
a、氧化性? b、还原性? c、氧化性和还原性? d、均不正确
(2)若反应转移了5.418×1023个电子,则产生的气体在标准状况下的体积是________L。
(3)将 氧化剂和还原剂的化学式及配平后的系数填入下列方框中,并求出电子转移的数目:
氧化剂和还原剂的化学式及配平后的系数填入下列方框中,并求出电子转移的数目: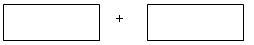
参考答案:(1)b;(2)10.08 (3)2 H2CrO4? 3 H2O2?6e-
本题解析:略
本题难度:一般
4、选择题 关于氧化剂的叙述正确的是(?)
A.分子中不一定含有氧元素
B.分子中一定含有氧元素
C.在反应中易失电子的物质
D.是反应生成的物质
参考答案:A
本题解析:略
本题难度:简单
5、选择题 相等物质的量的KClO3分别发生下述反应:①有MnO2催化剂存在时,受热分解得到氧气; ②若不使用催化剂,加热至470?℃左右,得到KClO4(高氯酸钾)和KCl。下列关于①和②的说法不正确的是
A.都是氧化还原反应
B.发生还原反应的元素相同
C.发生氧化反应的元素不同
D.生成KCl的物质的量相同
参考答案:D
本题解析:
本题难度:简单