1、计算题 某稀溶液中含4molKNO3和2.5molH2SO4,向其中加入1.5molFe粉,充分反应后产生的气体在标况下的体积为(? )
A.36L
B.28L
C.22.4L
D.11.2L
参考答案:B
本题解析:因为硝酸有强氧化性,铁没有过量的情况下,没机会成生亚铁。
反应如下:
Fe + 4HNO3 = Fe(NO3)3 + NO↑ + H2O
如果铁过量,有机会发生:
Fe + 2Fe(NO3)3 = 3Fe(NO3)2
题目中,整个过程都是发生:
Fe + 4HNO3 = Fe(NO3)3 + NO↑ + H2O--------(1)这个反应的。
根据题目中硝酸钾与硫酸的量,可知,溶液中有4摩尔硝酸。
第一次反应,4摩尔硝酸与1摩尔铁反应,生成1摩尔硝酸铁和1摩尔NO。
生成的1摩尔硫酸铁与剩余的1摩尔氢离子又得到1摩尔的硝酸,再与剩下的0.5摩尔铁,再发生:
Fe + 4HNO3 = Fe(NO3)3 + NO↑ + H2O--------(2)
因为硝酸只有1摩尔,又没有氢离子补充,所以(2)这个反应,只有0.25摩尔铁参加,再生成0.25摩尔NO.
这样气体总物质的量生成1.25mol ,体积是28升。
然后剩余的0.25mol铁,与硝酸铁再发生:
Fe + 2Fe(NO3)3 = 3Fe(NO3)2这个反应。
反应到此结束.
点评:此题要注意反应的实质。是硝酸根和氢离子与金属的反应。只要能提供硝酸根和氢离子反应就能进行。
本题难度:一般
2、计算题 向100 ml浓硫酸中加入64 g铜片,加热一段时间后,至不再反应为止,请回答下列问题:
(1)写出反应的化学方程式:?。
(2)若反应中有1.5 mol电子转移,被还原的硫酸为?mol,标准状况下生成的SO2气体体积为?L。
(3)将(2)反应后液体过滤,加水稀释滤液至500 ml,加足量Zn粉,经足够长的时间后,放出标准状况下6.72L H2,则反应的Zn的质量为?g,原浓硫酸的物质的量浓度为
?mol·L-1。
参考答案:(1)Cu+2H2SO4 (浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
(2)0.75 mol;? 16.8 L? (3)19.5 g;? 18 mol·L-1
本题解析:考查根据方程式进行的有关计算。
(1)在加热的条件下,浓硫酸能和铜反应,方程式为Cu+2H2SO4 (浓) CuSO4+SO2↑+2H2O。
CuSO4+SO2↑+2H2O。
(2)在反应硫酸中硫的化合价从+6价降低到+4价,转移2个电子,所以若反应中有1.5 mol电子转移,被还原的硫酸为1.5mol÷2=0.75 mol。生成的SO2是0.75 mol,其标准状况下的体积是0.75 mol×22.4L=16.8 L。同时生成硫酸铜是0.75mol,参加反应的硫酸是1.5mol。
(3)稀释后是稀硫酸,和锌反应生成氢气,方程式为Zn+H2SO4=ZnSO4+H2↑。根据题意可知,氢气是6.72L÷22.4L/mol=0.3mol,所以参加反应的锌也是0.3mol。但锌也和溶液中的硫酸铜反应,方程式为Zn+CuSO4=ZnSO4+Cu。根据(2)可知消耗锌是0.75mol,所以消耗锌的总质量是1.05mol×65g/mol=68.25g,参加反应的硫酸是0.3mol。因此根据(2)可知原溶液中硫酸是1.5mol+0.3mol=1.8mol,所以硫酸的浓度是1.8mol÷0.1L=18mol/L。
本题难度:一般
3、选择题 制备食用碘盐(KIO3)原理之一为:I2 +2KClO3 Cl2 +2KIO3,下列说法正确的是
Cl2 +2KIO3,下列说法正确的是
A.KClO3和KIO3均属于离子化合物,只含有离子键
B.反应过程中I2置换出Cl2,由此可推断非金属性I>Cl
C.为防止反应的尾气造成大气污染,可以用饱和食盐水吸收尾气
D.制备KIO3的反应中I2被氧化
参考答案:D
本题解析:A、KClO3和KIO3均属于离子化合物,既含有离子键,也含有共价键,A不正确;B、在反应中单质碘是还原剂,KClO3是氧化剂,非金属性应该是Cl>I,B不正确;C、氯气在饱和食盐水中的溶解度很小,应该用氢氧化钠溶液吸收,C不正确;D、碘元素的化合价从0价升高到+5价,失去电子被氧化,发生氧化反应,D正确,答案选D。
本题难度:一般
4、填空题 (4分)在酸性条件下,许多氧化剂可使KI溶液中的I-氧化,
例如KIO3(IO3-→I2)、H2O2(H2O2→H2O)、FeCl3(Fe3+→Fe2+)、K2Cr2O7(Cr2O72-→Cr3+)。请根据题目要求填空:
(1)写出在醋酸存在的条件下KIO3溶液与KI溶液反应的离子方程式?
?;
(2)在酸性条件下(足量),各取1 L浓度为1 mol·L-1的KI溶液分别与上述列举四种溶液进行完全反应,则需要溶质的物质的量之比为n(KIO3):n(H2O2):n(FeCl3):n(K2Cr2O7)=?:?:?:?.
参考答案:(1)IO-3+5I-+6CH3COOH?3I2+3H2O+6CH3COO-(2)6 : 15 : 30 : 5
本题解析:略
本题难度:简单
5、实验题 A、B、C、D、E为原子序数依次增大的5种短周期元素,A最外层电子数是其电子层数的两倍;B能形成双原子阴离子;C与B能形成两种常见的离子化合物,B、E同主族,C、D、E的最高价氧化物对应的水化物之间两两皆能反应生成盐和水。请回答下列问题:
(1)B的双原子阴离子电子式为?:用化学式表示一种由B、C、E组成的物质?。
(2)B的氢化物比E的氢化物的沸点??(填“高”或“低”),理由是?。
(3)B、C、D组成化合物的水溶液与过量AB2反应的离子方程式?。
(4)已知X是由上述五种元素中的两种组成的离子化合物,其离子具有相同的电子层结构,气体甲是天然气的主要成分。

i.写出反应①的化学方程式?。
ii.若红色固体乙是一种单质,写出反应③的化学方稈式?。
(5)若某气体含有AB2和EB2中的一种或两种,请设计实验方案,探究该气体的成分?。
参考答案:(1)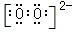 ? Na2SO4、Na2SO3 、Na2S2O3(写出其中一种)
? Na2SO4、Na2SO3 、Na2S2O3(写出其中一种)
(2)高?水分子间存在氢键?(3)AlO2-+CO2+2H2O=Al(OH)3↓+HCO3―
(4) Al4C3+12H2O=4Al(OH)3↓+3CH4↑; CH4 + 4CuO高温4Cu+CO2+2H2O
(5)将气体依次通过盛有酸性高锰酸钾溶液、品红溶液、澄清石灰水的洗气瓶,若酸性高锰酸钾溶液褪色(或变浅),且品红不褪色、澄清石灰水变浑浊,为SO2、CO2的混合气体,若只有酸性高锰酸钾溶液褪色(或变浅),为SO2气体,若只有澄清石灰水变浑浊,为CO2气体
本题解析:A、B、C、D、E为原子序数依次增大的5种短周期元素,A最外层电子数是其电子层数的两倍,则A可能是碳元素或硫元素,由于A的原子序数最小,因此A应该是碳元素;B能形成双原子阴离子;C与B能形成两种常见的离子化合物,B、E同主族,C、D、E的最高价氧化物对应的水化物之间两两皆能反应生成盐和水,因此一定是氢氧化铝与酸碱的反应,则D是铝,C是钠,B是氧元素,E是硫元素。
(1)B的双原子阴离子是过氧根离子,电子式为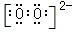 :由B、C、E组成的物质有Na2SO4、Na2SO3 、Na2S2O3。
:由B、C、E组成的物质有Na2SO4、Na2SO3 、Na2S2O3。
(2)由于水分子间存在氢键,所以B的氢化物比E的氢化物的沸点高。
(3)B、C、D组成化合物是偏铝酸钠,其水溶液与过量二氧化碳反应的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3―。
(4)气体甲是天然气的主要成分,则甲是甲烷。X与水反应生成甲烷和沉淀,沉淀能溶于氢氧化钠,应该是氢氧化铝沉淀,则X中含有铝元素,因此X是碳化铝,化学式为Al4C3,碳化铝与水反应的化学方程式为Al4C3+12H2O=4Al(OH)3↓+3CH4↑。若红色固体乙是一种单质,则该单质是铜,这说明甲烷与氧化铜发生了氧化还原反应生成铜、二氧化碳和水,则反应③的化学方稈式CH4 + 4CuO高温4Cu+CO2+2H2O。
(5)二氧化碳、二氧化硫均能使澄清石灰水变浑浊,但二氧化硫还具有还原性和漂白性,据此检验即可,即将气体依次通过盛有酸性高锰酸钾溶液、品红溶液、澄清石灰水的洗气瓶,若酸性高锰酸钾溶液褪色(或变浅),且品红不褪色、澄清石灰水变浑浊,为SO2、CO2的混合气体,若只有酸性高锰酸钾溶液褪色(或变浅),为SO2气体,若只有澄清石灰水变浑浊,为CO2气体。
本题难度:一般