1ЎўСЎФсМв әгОВЈ®әгИЭКұN2ЈЁgЈ©+3H2ЈЁgЈ©ЁT2NH3ЈЁgЈ©Ј¬ПВБРёчЖрКјМхјюПВөД·ҙУҰҙпөҪЖҪәвКұУлAКЗН¬Т»ЖҪәвЧҙМ¬өДКЗЈЁ ? Ј©
AЈ®1mol3mol0mol
BЈ®0mol0mol2mol
CЈ®0.5mol1mol1mol
DЈ®1mol3mol2mol
2ЎўМоҝХМв ЕрЛб(H3BO3)ФЪКіЖ·ЎўТҪТ©БмУтУҰУГ№г·әЎЈ
(1)ЗлНкіЙB2H6ЖшМеУлЛ®·ҙУҰөД»ҜС§·ҪіМКҪЈәB2H6Ј«6H2OЈҪ2H3BO3Ј«________ЎЈ
(2)ФЪЖдЛыМхјюПаН¬КұЈ¬·ҙУҰH3BO3Ј«3CH3OH? B(OCH3)3?Ј«3H2OЦРЈ¬H3BO3өДЧӘ»ҜВК(ҰБ)ФЪІ»Н¬ОВ¶ИПВЛж·ҙУҰКұјд(t)өДұд»ҜјыПВНјЈ¬
B(OCH3)3?Ј«3H2OЦРЈ¬H3BO3өДЧӘ»ҜВК(ҰБ)ФЪІ»Н¬ОВ¶ИПВЛж·ҙУҰКұјд(t)өДұд»ҜјыПВНјЈ¬
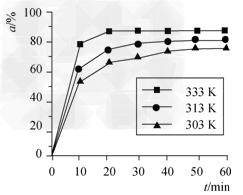
УЙҙЛНјҝЙөГіцЈә ?
ўЩОВ¶И¶ФёГ·ҙУҰөД·ҙУҰЛЩВКәНЖҪәвТЖ¶ҜөДУ°ПмКЗ__________________ЎЈ
ўЪёГ·ҙУҰөДҰӨH________0(МоЎ°<ЎұЎ°ЈҪЎұ»тЎ°>Ўұ)ЎЈ
(3)H3BO3ИЬТәЦРҙжФЪИзПВ·ҙУҰЈә H3BO3(aq)Ј«H2O(l) [B(OH)4]Јӯ(aq)Ј«H?Ј«(aq)ТСЦӘ0.70?mol/L?H3BO3ИЬТәЦРЈ¬ЙПКц·ҙУҰУЪ298?KҙпөҪЖҪәвКұЈ¬cЖҪәв(HЈ«)ЈҪ2.0ЎБ10Јӯ5?mol/LЈ¬cЖҪәв(H3BO3)ЎЦcЖрКј(H3BO3)Ј¬Л®өДөзАлҝЙәцВФІ»јЖЈ¬ЗуҙЛОВ¶ИПВёГ·ҙУҰөДЖҪәвіЈКэK_________H2OөДЖҪәвЕЁ¶ИІ»БРИлKөДұнҙпКҪЦРЈЁјЖЛгҪб№ыұЈБфБҪО»УРР§КэЧЦ)ЎЈ
[B(OH)4]Јӯ(aq)Ј«H?Ј«(aq)ТСЦӘ0.70?mol/L?H3BO3ИЬТәЦРЈ¬ЙПКц·ҙУҰУЪ298?KҙпөҪЖҪәвКұЈ¬cЖҪәв(HЈ«)ЈҪ2.0ЎБ10Јӯ5?mol/LЈ¬cЖҪәв(H3BO3)ЎЦcЖрКј(H3BO3)Ј¬Л®өДөзАлҝЙәцВФІ»јЖЈ¬ЗуҙЛОВ¶ИПВёГ·ҙУҰөДЖҪәвіЈКэK_________H2OөДЖҪәвЕЁ¶ИІ»БРИлKөДұнҙпКҪЦРЈЁјЖЛгҪб№ыұЈБфБҪО»УРР§КэЧЦ)ЎЈ
3ЎўСЎФсМв ПВБРРрКцІ»ХэИ·өДКЗЈЁ ? Ј©
AЈ®»ҜС§ЖҪәв·ўЙъТЖ¶ҜЈ¬ЖҪәвіЈКэІ»Т»¶Ё·ўЙъұд»Ҝ
BЈ®ЙэёЯОВ¶И»бФцҙу»ҜС§·ҙУҰЛЩВКЈ¬ЖдФӯА§КЗФцјУБЛ»о»Ҝ·ЦЧУөД°Щ·ЦКэ
CЈ®
Ді»ҜС§·ҙУҰөДДЬБҝұд»ҜИзНјЛщКҫЈ¬ФтёГ·ҙУҰөДЎчHЈҫ0Ј®ЎчSЈҫ0
DЈ®H3PO4өДөзАліЈКэЈәKalЈҫЈҫKa2ЈҫЈҫKa3
4ЎўСЎФсМв
|
ПВНјКЗҝЙДж·ҙУҰX2+3Y2 2Z2 ФЪ·ҙУҰ№эіМЦРөД·ҙУҰЛЩВКЈЁVЈ©УлКұјдЈЁtЈ©өД№ШПөЗъПЯЈ¬ПВБРРрКцХэИ·өДКЗ
2Z2 ФЪ·ҙУҰ№эіМЦРөД·ҙУҰЛЩВКЈЁVЈ©УлКұјдЈЁtЈ©өД№ШПөЗъПЯЈ¬ПВБРРрКцХэИ·өДКЗ
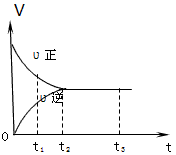
[? ]
AЈ®t1КұЈ¬Ц»УРХэ·ҪПт·ҙУҰ
BЈ®t2КұЈ¬·ҙУҰөҪҙпПЮ¶И
CЈ®t2- t3Ј¬·ҙУҰІ»ФЩ·ўЙъ
DЈ®t2- t3Ј¬ёчОпЦКөДЕЁ¶ИІ»ФЩ·ўЙъұд»Ҝ
5ЎўСЎФсМв ПВБР·ҙУҰҙҰУЪЖҪәвЧҙМ¬Ј¬2SO2ЈЁgЈ©+O2ЈЁgЈ©?

2SO3ЈЁgЈ©ЎчH=-200kJ?mol-1Ј¬УыМбёЯЖҪәвіЈКэKөДЦөЈ¬УҰІЙИЎөДҙлК©КЗЈЁЎЎЎЎЈ©
AЈ®ҪөөНОВ¶И
BЈ®ФцҙуС№БҰ
CЈ®јУИлСхЖш
DЈ®ИҘөфИэСх»ҜБт