1、填空题 (12分)以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:

回答下列问题:
(1)在一定条件下,SO2转化为SO3的反应为2SO2(g)+O2(g) 2SO3(g),该反应的平衡常数表达式为K= ?;过量的SO2与NaOH溶液反应的化学方程式为?
2SO3(g),该反应的平衡常数表达式为K= ?;过量的SO2与NaOH溶液反应的化学方程式为?
?
(2)酸溶及后续过程中均需保持盐酸过量,其目的是?、?。
(3)通氯气氧化时,发生的主要反应的离子方程式为?
该过程产生的尾气可用碱溶液吸收,尾气中污染空气的气体为?(写化学式)。
参考答案:(12分)(1)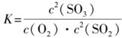 ? SO2+NaOH=NaHSO3
? SO2+NaOH=NaHSO3
(2)提高铁元素的浸出率?抑制Fe3+水解
(3)Cl2+2Fe2+=2Cl—+2Fe3+? Cl2、HCl
本题解析:】(1)平衡常数是指在一定条件下可逆反应达到平衡时,生成物浓度的幂之积与反应物浓度幂之积的比值。所以该反应的平衡常数表达式为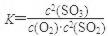 。过量的SO2与NaOH溶液反应生成物是酸式盐,方程式为SO2+NaOH===NaHSO3。
。过量的SO2与NaOH溶液反应生成物是酸式盐,方程式为SO2+NaOH===NaHSO3。
(2)因为Fe3+在溶液中易水解,所以为了抑制水解需要加入盐酸。
(3)因为溶液中可能会生成Fe2+,所以为了抑制其生成,需要加入氧化剂氯气,方程式为Cl2+2Fe2+===2Cl-+2Fe3+。
本题难度:一般
2、填空题 焦亚硫酸钠(Na2S2O5)常用作食品漂白剂。其制备工艺流程如下:

已知:反应Ⅱ包含2NaHSO3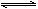 Na2S2O5+H2O等多步反应。
Na2S2O5+H2O等多步反应。
(1)实验室制取氨气的化学方程式:?。
(2)“灼烧”时发生反应的化学方程式:?。
(3)已知Na2S2O5与稀硫酸反应放出SO2,其离子方程式为:?。
(4)副产品X的化学式是:?;可循环利用的物质是:_________和_______。
(5)为了减少产品Na2S2O5中杂质含量,需控制反应Ⅱ中气体与固体的物质的量之比约为?。
参考答案:
(1)2NH4Cl+Ca(OH)2 2NH3↑+CaCl2+2H2O?(2分)
2NH3↑+CaCl2+2H2O?(2分)
(2)2CuS+3O2 2CuO+2SO2?(2分)
2CuO+2SO2?(2分)
(3) S2O52-+2H+=2SO2↑+H2O?(2分)
(4) CuSO4?5H2O (2分)? CO2、H2O (各2分,共4分)?(5)2∶1?(2分)
本题解析:⑴实验室中制备氨气是用固体的氢氧化钙和固体的氯化铵来制备。(2)硫化铜灼烧一定生成氧化铜和二氧化硫。(3)根椐提示可知生成二氧化硫和水。(4)从生产过程可以看出是硫酸铜晶体;从图示中可以看出二氧化碳和水可以再次利用;反应Ⅱ中气体与固体分别是二氧化硫和碳酸钠,这两种物质反应必须生成亚硫酸氢钠:Na2CO3+2SO2=2NaHSO3+CO2;因此气体与固体的物质的量之比为:2∶1
本题难度:一般
3、选择题 氢能开发的首要问题是研究如何以水为原料制取氢气。下列研究方向中你认为比较可行的是(?)
A.大量建设水电站,用电力分解水制取氢气
B.设法将太阳能聚焦,产生高温,使水分解产生氢气
C.寻找更多化石燃料,利用其燃烧放热,使水分解产生氢气
D.寻找特殊化学物质,用于开发廉价能源,以分解水制取氢气
参考答案:B
本题解析:电力分解水制取氢气,会消耗大量的电能,不经济,A不正确;化石燃料的储藏量是有限的,且燃烧会造成环境污染,C不正确;水分解需要消耗大量的能源,选项D不正确,B水可行,答案选B。
点评:化学与可持续发展及环境保护尽管不是教学的重点,但该内容与我们的生产、生活息息相关,因此成为历年高考的必考的热点。主要是把化学知识与实际生产、生活、环境保护及科技前沿等问题结合起来,突出化学与可持续发展、环境保护的密切联系,综合考查学生分析问题、解决问题的能力。
本题难度:简单
4、填空题 (10分)以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:

回答下列问题:
(1)过量的SO2与NaOH溶液反应的离子方程式为?。
(2)酸溶及后续过程中均需保持盐酸过量,其目的是?、?。
(3)通氯气氧化时,发生的主要反应的离子方程式为?;该过程产生的
尾气可用碱溶液吸收,尾气中污染空气的气体为?(写化学式)。
参考答案:(每空2分,共10分)(1)SO2+OH=HSO3-
(2)提高铁元素的浸出率?抑制Fe3+水解
(3)Cl2+Fe2+=2Cl-+Fe3+? Cl2和HCl
本题解析:(1)过量的SO2与NaOH溶液反应,应该是生成亚硫酸氢钠,所以反应的离子方程式是O2+OH=HSO3-。
(2)一方面盐酸过量,可以提高铁元素的浸出率;另一方面,由于氯化铁在溶液中存在水解平衡,所以过量的盐酸可以抑制铁离子的水解,因此酸溶及后续过程中均需保持盐酸过量的目的是提高铁元素的浸出率和抑制Fe3+水解。
(3)溶液中含有亚铁离子,所以通入氯气发生的主要反应的离子方程式是Cl2+Fe2+=2Cl-+Fe3+;由于通入氯气,所以尾气中含有氯气。又因为盐酸易挥发出氯化氢气体,所以尾气中还含有氯化氢气体。
本题难度:一般
5、选择题 海水是重要的资源。可以制备一系列物质
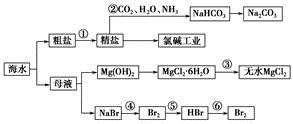
下列说法正确的是
A.步骤②中,应先通CO2,再通NH3
B.步骤③可将MgCl2·6H2O晶体在空气中直接加热脱水
C.步骤④、⑤、⑥反应中,溴元素均被氧化
D.除去粗盐中的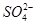 、Ca2+、Mg2+等杂质,加入试剂及相关操作顺序可以是:NaOH溶液→BaCl2溶液→Na2CO3溶液→过滤→盐酸
、Ca2+、Mg2+等杂质,加入试剂及相关操作顺序可以是:NaOH溶液→BaCl2溶液→Na2CO3溶液→过滤→盐酸
参考答案:D
本题解析:A项,步骤②为侯氏制碱法,由于NH3的溶解度比CO2大,故应先通NH3,再通CO2溶液中才能含有大量的碳元素,才能得到大量的NaHCO3,错误;MgCl2·6H2O直接加热脱水时,Mg2+水解生成HCl挥发出去,促进水解进行到底,得到Mg(OH)2。所以晶体加热脱水必须不断通入HCl,抑制水解,B项错;C项,步骤⑤中,Br化合价降低,被还原,错;D项,加NaOH能除去Mg2+,加Ba2+能除去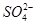 ,再加入Na2CO3可以除去Ca2+以及过量的Ba2+,过滤后加入盐酸可以除去多余的
,再加入Na2CO3可以除去Ca2+以及过量的Ba2+,过滤后加入盐酸可以除去多余的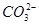 和OH-,正确。
和OH-,正确。
本题难度:一般