1、填空题 某元素X的激发态原子的电子排布式为1s22s22p63s13p3,则该元素基态原子的电子排布式为_________,
其最高价氧化物属于___________晶体;Z原子的核电荷数为33,其在元素周期表中的位置是_________,属于___________区的元素。
2、选择题 下列化学用语正确的是( )
A.锂离子的结构示意图:
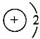
B.碳原子的轨道表示式:

C.丁烷的最简式:C2H5
D.氯化镁的电子式:
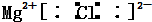
3、选择题 2005年美国《Science》上发表论文,宣布发现了一种Al的超原子结构,这种超原子(Al13)是以1个Al原子在中心,12个Al原子在表面形成的三角二十面体结构.这种超原子具有40个价电子时最稳定.请预测稳定的Al13所带的电荷为( )
A.3+
B.2+
C.0
D.1-
4、选择题 若某原子在处于能量最低状态时,外围电子排布为4d15s2,则下列说法正确的是( )
A.该元素原子最外层共有3个电子
B.该元素位于第5周期ⅡA族
C.该元素原子核外第N层上共有9个不同状态的电子
D.该元素原子第四电子层上有5个空轨道
5、简答题 A、B、C、D、E、F为原子序数依次增大的短周期主族元素.A、F原子的最外层电子数均等于其周期序数,F原子的电子层数是A的3倍;B原子核外电子分处3个不同能级,且每个能级上排布的电子数相同;A与C形成的最简单分子为三角锥形;D原子p轨道上成对电子数等于未成对电子数;E原子核外每个原子轨道上的电子都已成对,E电负性小于F.
(1)写出B的基态原子的核外电子排布式______.
(2)A、C形成的最简单分子极易溶于水,其主要原因是______;与该最简单分子互为等电子体的阳离子为______.
(3)比较E、F的第一电离能:E______F(选填“>”或“<”,“=”).
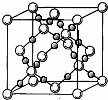
(4)BD2在高温高压下所形成的晶胞如右图所示.该晶体的类型属于______(选填“分子”、“原子”、“离子”或“金属”)晶体,该晶体中B原子的杂化形式为______.
(5)光谱证实单质F与强碱性溶液反应有[F(OH)4]-生成,则[F(OH)4]-中存在______.
a.共价键b.非极性键c.配位键d.σ键e.π键.