1、选择题 在Al2(SO4)3、K2SO4和明矾的混和溶液中,如果c(SO42-)等于0.2mol/L,当加入等体积的0.2mol/L的KOH溶液时,生成的沉淀恰好溶解,则原和物中K+的物质的浓度为( ? )
A.0.2mol/L
B.0.25mol/L
C.0.45mol/L
D.0.225mol/L
参考答案:B
本题解析:略
本题难度:简单
2、计算题 现欲配制100mL 1.0 mol/L的硫酸铜(CuSO4)溶液,试求:
(1)若用无水硫酸铜配制,则需要无水硫酸铜粉末的质量是多少?
(2)若用5.0 mol/L CuSO4溶液配制,则需要该溶液多少毫升?
(3)若用胆矾(CuSO4·5H2O)配制,则需要胆矾的质量是多少?
参考答案:(1)16g
(2)20mL
(3)25g
本题解析:
本题难度:一般
3、计算题 2.16g X2O5中含有0.1mol 氧原子,求X的摩尔质量。
参考答案:14g/mol
本题解析:假设X2O5中X的摩尔质量为ag/mol,则有整个X2O5的摩尔质量表示为:2a+5×16=(2a+80)g/mol。2.16gX2O5物质的量为2.16/(2a+80)mol.
由于题目给出氧原子物质的量为0.1mol,所以有5·[2.16/(2a+80)]=0.1
求出a=14g/mol
本题难度:一般
4、选择题 某KCl、MgCl2、Mg(NO3)2形成的混合液中,c(K+)=0.1mol/L,
c(Mg2+)=0.25mol/L,c(Cl-)=0.2mol/L,则c(NO3-)为? (?)
A.0.15mol/L
B.0.10mol/L
C.0.25mol/L
D.0.40mol/L
参考答案:D
本题解析:略
本题难度:简单
5、填空题 (1)①现有11g由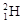 和
和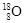 组成的水分子的物质的量?mol,其中含中子数为?mol,电子数为?个。
组成的水分子的物质的量?mol,其中含中子数为?mol,电子数为?个。
②请画出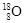 2-微粒的结构示意图:??。
2-微粒的结构示意图:??。
(2)质量相等的两种物质SO2和SO3,两种物质中硫元素质量之比为?,分子物质的量之比为?,所含氧原子个数之比为?。
(3)0.2L 0.5mol/L Al2(SO4)3溶液和0.5L 0.5mol/L Al2(SO4)3溶液所含SO42—离子浓度之比为____________,SO42—离子数目之比为____________。
(4)20.6g NaR 含有Na+0.2mol,则NaR的摩尔质量为?,则含R 8.0g 的NaR的物质的量为?mol 。
(5)实验室用二氧化锰与浓盐酸反应制取氯气,反应方程式如下:
MnO2+4HCl(浓) MnCl2+2H2O+Cl2↑。若0.1 molMnO4与足量的浓盐酸充分反应,则有?mol HCl被氧化,转移电子的物质的量为?mol,产生的Cl 2在标准状况下的体积为?L。
MnCl2+2H2O+Cl2↑。若0.1 molMnO4与足量的浓盐酸充分反应,则有?mol HCl被氧化,转移电子的物质的量为?mol,产生的Cl 2在标准状况下的体积为?L。
参考答案:(1)①0.5? 6? 5NA?②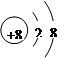
(2)5:4? 5:4? 5:6?(3)1:1 ?2:5?(4)103g/mol? 0.1?(5)0.2? 0.2? 2.24
本题解析:(1)①由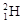 和
和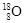 组成的水分子的摩尔质量是22g/mol,所以11g由
组成的水分子的摩尔质量是22g/mol,所以11g由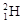 和
和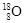 组成的水分子的物质的量=11g÷22g/mol=0.5mol。又因为质子数+中子数=质量数,所以其中含中子数为[(2-1)×2+18-8]×0.5mol=6mol。由于质子数=核外电子数,所以电子数为(1×2+8)×0.5×NA=5NA?个。
组成的水分子的物质的量=11g÷22g/mol=0.5mol。又因为质子数+中子数=质量数,所以其中含中子数为[(2-1)×2+18-8]×0.5mol=6mol。由于质子数=核外电子数,所以电子数为(1×2+8)×0.5×NA=5NA?个。
②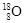 2-微粒的核外电子数是8+2=10个,所以该微粒的结构示意图为
2-微粒的核外电子数是8+2=10个,所以该微粒的结构示意图为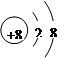 。
。
(2)质量相等的两种物质SO2和SO3,其物质的量之比=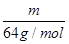 :
: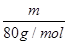 =5:4,所以两种物质中硫元素质量之比为5:4,分子物质的量之比为5:4,所含氧原子个数之比为2×5:3×4=5:6。
=5:4,所以两种物质中硫元素质量之比为5:4,分子物质的量之比为5:4,所含氧原子个数之比为2×5:3×4=5:6。
(3)0.2L 0.5mol/L Al2(SO4)3溶液中SO42—离子浓度是0.5mol/L×3=1.5mol/L,0.5L 0.5mol/L Al2(SO4)3溶液中SO42—离子浓度=0.5mol/L×3=1.5mol/L,因此所含SO42—离子浓度之比为1:1,SO42—离子数目之比为0.2L×1.5mol/L:0.5L×1.5mol/L=2:5。
(4)20.6g NaR 含有Na+0.2mol,则NaR的物质的量也是0.2mol,则其摩尔质量为20.6g÷0.2mol=103g/mol。这说明R的相对原子质量是103-23=80,则8.0gR的物质的量=8.0g÷80g/mol=0.1mol,所以含R 8.0g 的NaR的物质的量也是0.1mol 。
(5)根据反应MnO2+4HCl(浓) MnCl2+2H2O+Cl2↑可知,镁消耗1mol二氧化锰的同时消耗4mol氯化氢,生成1mol氯气,这说明被氧化的氯化氢是2mol,所以若0.1 molMnO4与足量的浓盐酸充分反应,则有0.2mol HCl被氧化。锰元素的化合价从+4价降低到+2价,因此转移电子的物质的量为(4-2)×0.1mol=0.2mol,氯气的物质的量是0.1mol,则产生的Cl 2在标准状况下的体积为?0.1mol×22.4L/mol=2.24L。
MnCl2+2H2O+Cl2↑可知,镁消耗1mol二氧化锰的同时消耗4mol氯化氢,生成1mol氯气,这说明被氧化的氯化氢是2mol,所以若0.1 molMnO4与足量的浓盐酸充分反应,则有0.2mol HCl被氧化。锰元素的化合价从+4价降低到+2价,因此转移电子的物质的量为(4-2)×0.1mol=0.2mol,氯气的物质的量是0.1mol,则产生的Cl 2在标准状况下的体积为?0.1mol×22.4L/mol=2.24L。
本题难度:一般