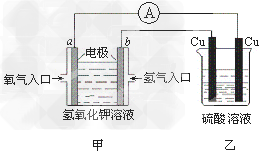
1、选择题 根据下图所示的装置(甲中电极均为惰性电极),判断下列叙述中正确的是
[? ]
A.利用该反应可持续产生硫酸铜直至硫酸耗尽
B.甲中a电极的电极反应为: O2+4H++4e-=2H2O
C.装置开始工作初期乙中的总反应为: Cu+H2SO4 CuSO4+H2↑
CuSO4+H2↑
D.反应过程中甲、乙装置中溶液的pH都逐渐减小
参考答案:C
本题解析:
本题难度:一般
2、选择题 把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,a为负极;c、d相连时,电流由d到c;a、c相连时c极上产生大量气泡。b、d相连时,b上有大量气泡产生,则四种金属的活动性顺序由强到弱的顺序为( )。
A.a>b>c>d
B.a>c>d>b
C.c>a>b>d
D.b>d>c>a
参考答案:B
本题解析:根据原电池原理,作为负极的金属活动性比正极的金属活动性强。电子流动方向是由负极流向正极,电流方向与电子流动方向相反,因此可依次作出如下判断,活动性:①a>b;②c>d;③a>c;④d>b,综上所述,金属活动性:a>c>d>b。
本题难度:一般
3、简答题 利用反应:2FeCl3+Cu=2FeCl2+CuCl2设计一个原电池装置.试回答:
(1)该原电池的正极材料是______,负极材料是______,电解质溶液是______.
(2)该原电池的负极反应式是______,正极反应式是______.
参考答案:(1)由反应“2FeCl3+Cu=2FeCl2+CuCl2”可知,反应中铜失电子而被氧化,应为原电池负极,正极应为活泼性比铜弱的金属或导电的非金属材料,Fe3+在正极得到电子而被还原,电解质溶液为FeCl3,
故答案为:石墨;铜;FeCl3溶液;
(2)负极上铜失电子发生氧化反应,正极上铁离子得电子发生还原反应,其电极反应式为:负极:Cu-2e-=Cu2+正极:2Fe3++2e-=2Fe2+,
故答案为:Cu-2e-=Cu2+正极:2Fe3++2e-=2Fe2+.
本题解析:
本题难度:简单
4、填空题 依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如下图,回答下列问题:
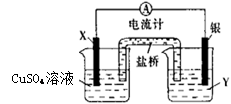
(1)电极X的材料是 ,电解质溶液Y是 。
(2)银电极为电池的 极。
(3)盐桥中阳离子向 移动(填“左 ”或“右”)。
(4)外电路中电子是从 (填电极材料名称,下同)电极流向 电极。
参考答案:(1)铜;AgNO3溶液(2)正(3)右(4)铜,银
本题解析:根据总反应式可知,图中一个简单的铜-银原电池构造,所以铜失电子做负极,X电极材料为金属铜;银离子得到电子被还原,银做正极,相应电解质溶液为AgNO3溶液;由于左边有大量Cu2+ 生成,所以为保持左边溶液电中性,会吸引盐桥中的阴离子向左移动;而相反右边电极Y有大量Ag单质析出,Ag+ 大量减少,会使盐桥中阳离子往右移动,而由铜失去的电子从外电路转移给银电极。
考点:本题考查的是原电池原理知识。
本题难度:一般
5、填空题 化学反应伴随着能量变化是化学反应的基本特征之一。 请填写下列空白:
(1)从能量的角度看,断开化学键要___(填“吸收”或“放出”,下同)能量;所有的燃烧反应都要____热量。
(2)有甲、乙、丙三种金属片,
①把甲、乙用导线连接后同时浸入稀硫酸中,乙上有气泡产生;
②将乙、丙用导线连接后同时浸入稀硫酸中,电子的流动方向为乙→导线→丙。
则在①中,金属片____(填“甲”或“乙”)发生氧化反应;
三种金属的活动性由强到弱的顺序是____。
(3)铜与浓硝酸反应时有____色NO2气体产生;当有1 mol HNO3参加反应时, HNO3得到电子的物质的量为____ mol。
参考答案:(1)吸收; 放出
(2)甲 ;甲>乙>丙
(3)红棕; 0.5
本题解析:
本题难度:一般