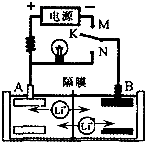
1、填空题 Ⅰ.钢铁工业是国家工业的基础.请回答钢铁腐蚀、防护过程中的有关问题.
请写出钢铁在碱性、潮湿的环境下发生电化学腐蚀正极的电极反应式:______下列哪个装置示意图可防止铁棒被腐蚀______.
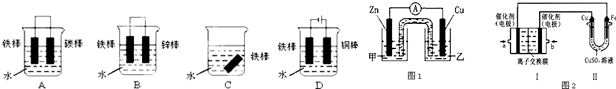
Ⅱ.某同学利用CuSO4溶液,进行以下实验探究.
①图1是根据反应Zn+CuSO4═Cu+ZnSO4设计成的锌铜原电池.Cu极的电极反应式是______,盐桥中是含有琼胶的KCl饱和溶液,电池工作时K+向______移动(填“甲”或“乙”).
②图2中,Ⅰ是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图,该同学想在Ⅱ中实现铁上镀铜,则b处通入的是______(填“CH4”或“O2”),a处电极上发生的电极反应式是______;当铜电极的质量变化3.2g,则消耗的CH4在标准状况下的体积为______L.
参考答案:I.钢铁在碱性、潮湿的环境下发生吸氧腐蚀,负极上铁失电子,正极上氧气得电子和水反应生成氢氧根离子,电极反应式为O2+2H2O+4e-=4OH-,金属铁作原电池正极或电解池阴极都被保护而防止被腐蚀,A装置中铁作原电池负极加快铁腐蚀,B装置中铁作原电池正极被保护,在C装置中,金属铁和水以及少量的氧气接触,也会被腐蚀,D装置中铁作电解池阴极被保护,故选BD;
故答案为:O2+2H2O+4e-=4OH-;BD;
II.①根据反应Zn+CuSO4═Cu+ZnSO4,结合图一可知,Zn为负极,Cu为正极,铜离子在Cu电极上得电子析出Cu,电极反应式为Cu2++2e-═Cu,
盐桥中是含有琼胶的KCl饱和溶液,电池工作时,Cl-向负极移动,K+向正极移动,所以,K+向乙装置移动,
故答案为:Cu2++2e-═Cu;乙;
②甲烷碱性燃料电池为电源,总电极反应式为CH4+2O2+2KOH=K2CO3+3H2O,负极发生氧化反应,正极发生还原反应,电镀时,镀件铁作电解池的阴极,连接甲烷燃料电源的负极,所以a应通入CH4,镀层金属作电解池的阳极,发生氧化反应,连接甲烷燃料电源的正极,所以b应通入O2.甲烷碱性燃料电池a处电极上CH4放电,发生氧化反应,电极反应式是CH4-8e-+10OH-=CO32-+7H2O,
根据电子转移守恒8n(CH4)=2n(Cu)=2×3.2g64g/mol=0.1mol,
n(CH4)=180mol,所以v(CH4)=180mol×22.4L/mol=0.28L,
故答案为:O2;CH4-8e-+10OH-=CO32-+7H2O;0.28.
本题解析:
本题难度:一般
2、选择题 (08郑州质量预测,9)电动自行车由于灵活、快捷、方便,已成为上班族的主要代步工具,其电源常用铅蓄电池,反应原理为:PbO2+Pb+2H2SO4 ?2PbSO4+2H2O?下列叙述正确的是(?)
?2PbSO4+2H2O?下列叙述正确的是(?)
A.放电时PbO2是电池的负极,电解质溶液的密度逐渐减小
B.放电时负极的电极反应式为:Pb+SO42--2e-=PbSO4↓
C.电池充电时,PbO2得电子被氧化
D.电池充电时,阴极电极反应式为:PbSO4+2H2O-2e-=PbO2+SO42-+4H-
参考答案:B
本题解析:本题考查原电池和电解池,中等提。放电时PbO2发生还原反应,为电池的正极,电解质溶液的密度逐渐减小,A错;充电时,PbSO4被氧化,PbO2为氧化产物,C错;充电时阴极发生还原反应:PbSO4+2e-=Pb+SO42-,D错。
本题难度:一般
3、选择题 电子表所用的某种纽扣电池的电极材料为Zn和Ag2O,电解质溶液是KOH溶液。电池总反应式为:Zn+Ag2O="ZnO+2Ag," 下列说法错误的是 ( )
A.该电池的正极是Ag2O,负极是Zn
B.该电池负极的电极反应式为:Zn+2OH——2e—=ZnO+H2O
C.理论上该电池工作一段时间后,溶液中KOH的浓度不变
D.该电池工作时,电解质中的阴离子向正极移动