1、选择题 锂电池是一代新型高能电池,它以质量轻、能量高而受到了普遍重视,目前已研制成功多种锂电池。某种锂电池的总反应式是Li+MnO2=LiMnO2。下列说法正确的是
[? ]
A.Li是负极,电极反应为Li-e-=Li+
B.Li是正极,电极反应为Li+e-=Li-
C.MnO2是负极,电极反应为MnO2+e-=MnO2-
D.锂电池是一种环保型电池
参考答案:AD
本题解析:
本题难度:一般
2、选择题 以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。关于该电池的叙述正确的是
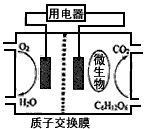
[? ]
A.该电池能够在高温下工作
B.电池的负极反应为:C6H12O6+6H2O-24e-==6CO2↑+24H+
C.放电过程中,H+从正极区向负极区迁移
D.在电池反应中,每消耗1mol氧气,理论上能生成标准状况下CO2气体22.4/6? L
参考答案:B
本题解析:
本题难度:一般
3、选择题 右图为铅蓄电池的示意图。下列说法正确的是

A.放电时,N为负极,其电极反应式为: PbO2+SO42-+4H++2e-=PbSO4+2H2O
B.放电时,c(H2SO4)不变,两极的质量增加
C.充电时,阳极反应式为:PbSO4+2e-= Pb+SO42-
D.充电时,若N连电源正极,则该极生成PbO2
参考答案:D
本题解析:铅蓄电池中Pb是负极二氧化铅是正极,A不正确;放电时消耗硫酸,所以硫酸的浓度降低,B不正确;充电相当于是放电的逆过程,所以充电时,阳极反应式为PbSO4+2H2O-2e-=PbO2+SO42-+4H+,C不正确,所以正确的答案选D。
点评:该题是基础性试题的考查,难度不大。该题的关键是明确放电和充电的关系,然后结合题干灵活分析即可,该题学生不难得分。
本题难度:简单
4、选择题 微型纽扣电池在现代生活中有广泛的应用,有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液是KOH,电极反应式为Zn+2OH--2e-===ZnO+H2O,Ag2O+H2O+2e-===2Ag+2OH-。总反应式是Ag2O+Zn===2Ag+ZnO。根据上述反应式,判断下列叙述中正确的是( )
A.在使用的过程中,电池负极区溶液的碱性减弱
B.在使用的过程中,电子由Ag2O极经外电路流向Zn极
C.Zn极是正极,Ag2O是负极
D.Zn电极发生还原反应,Ag2O电极发生氧化反应
参考答案:A
本题解析:考查原电池的判断。在原电池中较活泼的金属作负极,失去电子,被氧化,发生氧化反应。正极得到电子,被还原,发生还原反应。根据电极反应式可知Zn失去电子,氧化银得到电子。锌所失的电子经导线传递到正极上,在正极上氧化银被还原。所以锌是负极,氧化银是正极。由于负极要消耗OH-,所以负极区域溶液的碱性是增强的。答案选A。
本题难度:简单
5、简答题 图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:
(1)当电极a为Al、电极b为Cu、电解质溶液为稀硫酸时,正极的电极反应式为:______.
(2)当电极a为Al、电极b为Mg、电解质溶液为氢氧化钠溶液时,该装置______(填“能”或“不能”)形成原电池,若不能,请说明理由,若能,请指出正、负极______.
(3)燃料电池的工作原理是将燃料和氧化剂(如O2)反应所放出的化学能直接转化为电能.现设计一燃料电池,以电极a为正极,电极b为负极,氢气为燃料,采用碱性溶液为电解液;则氢气应通入______极(填a或b,下同),电子从______极流出.a极发生电极反应式为:______.
参考答案:(1)Al、Cu、稀硫酸构成的原电池,金属铝做负极,金属铜为正极,正极发生还原反应,电极反应为:2H++2e-=H2↑,故答案为:2H++2e-=H2↑;
(2)Al、Mg、氢氧化钠溶液能之间.金属铝和氢氧化钠可以发生氧化还原反应,能设计成原电池,失电子的是金属铝,为负极,金属镁为正极,
故答案为:能;镁为正极,铝为负极;
(3)氢氧燃料电池中,燃料氢气需通在负极,正极是氧气得电子,电子从负极流向正极,故答案为:b;b;O2+2H2O+4e-=4OH-.
本题解析:
本题难度:一般