1、选择题 下列叙述正确的是( ? )
A.HBr分子的电子式为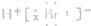
B.PCl3和BCl3分子中所有原子的最外层都达到8电子稳定结构
C.SiH4的沸点高于CH4,可推测PH3的沸点高于NH3
D.熔点由高到低的顺序是;金刚石>碳化硅>晶体硅
参考答案:D
本题解析:
本题难度:一般
2、选择题 位于同一周期的五种短周期元素A、B、C、D、E它们的原子序数依次增大,已知A、B为金属,其余为非金属。A、B原子序数之和数值上等于A元素的原子量;C、D的最外层电子数均为偶数;电解熔融的化合物BE2是工业上生产单质B的方法。下列叙述正确的是
[? ]
A.A的氧化物的熔点大于B的氧化物
B.C既能与强酸溶液也能与强碱溶液反应
C.D、E的单质均能与氧气直接化合生成其最高价氧化物
D.含A、E元素的某物质具有漂白作用
参考答案:D
本题解析:
本题难度:一般
3、选择题 按电子排布,可把周期表里的元素划分成5个区,以下元素属于P区的是( )
A.Fe
B.Mg
C.P
D.La
参考答案:A、Fe的外围电子排布为3d64s2,属于d区元素,故A不符合;
B、Mg的外围电子排布为3s2,属于s区元素,故B不符合;
C、P的外围电子排布为3s23p4,所以p区元素,故C符合;
D、La为镧元素,属于f区,故D不符合;
故选C.
本题解析:
本题难度:简单
4、选择题 下列物质性质比较正确的是( )
A.热稳定性:HCl>H2S>H2O
B.离子半径:Na+>Cl一>F-
C.碱性:NaOH>Mg(OH)2>Al(OH)3
D.熔点:金刚石>干冰>食盐
参考答案:A、非金属性越强,气态氢化物越稳定,非金属性O>Cl>S,则氢化物稳定性为H2O>HCl>H2S,故A错误;
B、电子层数越多半径越大,电子层数相同时原子序数越大半径越小,所以离子半径:Cl一>F->Na+,故B错误;
C、元素的金属性越强其对应的最高价氧化物对应的水化物的碱性越强,金属性:Na>Mg>Al,则碱性:NaOH>Mg(OH)2>Al(OH)3,故C正确;
D、熔点的一般规律为:原子晶体>离子晶体>分子晶体,所以熔点:金刚石>食盐>干冰,故D错误;
故选C.
本题解析:
本题难度:一般
5、选择题 钯(Pd)元素的原子序数为46,下列叙述错误的是
[? ]
A.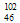 Pd和
Pd和 Pd互为同位素?
Pd互为同位素?
B.钯是第五周期元素
C.Pd2+核外有48个电子? ?
D.?Pd的原子核内有62个中子
参考答案:C
本题解析:
本题难度:简单