1、填空题 (12分)工业上需要利用一批回收的含铜废料制造胆矾(CuSO4·5H2O)。该废料中各种成份含量如下:Cu和CuO约占87%,其它为Al、Fe、Si及其氧化物,还有少量的难溶物质。工艺流程为:

部分金属阳离子以氢氧化物形式完全沉淀时溶液的pH如下表:
沉淀物
| Al(OH)3
| Fe(OH)3
| Cu(OH)2
| Mg(OH)2
| Fe(OH)2
|
pH
| 5.2
| 3.1
| 6.7
| 9.4
| 9.7
|
回答:
(1)步骤①中为什么要将含铜废料研磨成粉状?
? ?。
?。
(2)步骤⑤中H2O2参加反应的离子方程式:? ?。
?。
(3)步骤⑥中调节溶液pH时适宜的物质是?。(填序号);
A.NaOH? B.氨水? C.Cu2(OH)2CO3? D.Cu(OH)2? E.MgCO3
步骤⑥中滤渣成份的化学式?。
(4)步骤⑦中用硫酸调节pH=2~3的原因是?。
(5)步骤⑧的分离操作是:? , 冷却结晶,??。?
参考答案:(12分)(1)增大固体反应物的表面积,增大化学反应的速率。
(2)? 2Fe2++H2O2 +2H+=2Fe3++2H2O 。?
(3)C、D?;? Fe(OH)3 。
(4)加热蒸发浓缩时会导致Cu2+发生水解生成Cu(OH)2,用硫酸调节pH=2~3是为了抑制Cu2+的水解,也不会引入杂质。?蒸发浓缩,??过滤。
本题解析:略
本题难度:一般
2、填空题 (10分)空气吹出法工艺,是目前“海水提溴”的最主要方法之一。其工艺流程如下:
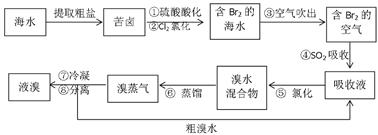
(1)溴在周期表中位于_________周期,_________族。
(2)步骤④的离子方程式:________________________________________?。
(3)步骤⑥的蒸馏过程中,溴出口温度为何要控制在80—90℃。温度过高或过低都不利于生产,请解释原因:___________________________________________?。
(4)步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离。若在实验室分离上述混合物的分离仪器的名称是___________,分离时液溴从分离器的_________(填“上口”或“下口”)排出。
(5)为什么不直接用含溴的海水进行蒸馏得到液溴,而要经过“空气吹出、SO2吸收、氯化”:?。
参考答案:
(1)第四?ⅦA(2分)
(2)Br2+SO2+2H2O=4H++2Br―+ SO42―(2分)
(3)温度过高,大量水蒸气排出,溴气中水增加;
温度过低,溴不能完全蒸出,吸收率低。?(2分)
(4)分液漏斗?下口?(2分)
(5)氯化后的海水虽然含有溴单质,但浓度低,如果直接蒸馏原料,产品成本高
“空气吹出、SO2吸收、氯化”的过程实际上是一个Br2的浓缩过程。(2分)
本题解析:略
本题难度:简单
3、简答题 据统计,2006年一季度江苏省粗钢产量为748.23万吨,同比增加254.86万吨;钢铁工业已成为我省重要的支柱产业.某大型铁矿附近有炼焦煤、石灰石、黏土矿和丰富的水资源.
(1)随着铁矿的开发,该地建立了如图所示位置关系的炼焦厂、钢铁厂、发电厂和水泥厂.请写出图中B、D所代表的两个工厂的名称:B.______;D.______.
(2)硫铁矿其外观如黄金,故其又被称为“愚人金”.现有黄金、愚人金两种小块试样,提供的仪器主要有:
A.托盘天平B.酒精喷灯C.试管夹D.坩埚钳E.烧杯F.量筒
另外,H2O、空气可任意选用,请回答问题:
①若用物理方法来鉴别该黄金、愚人金试样,应选用的仪器为______(填代号);
②若用化学方法来鉴别该黄金、愚人金试样,应选用的仪器为______(填代号).
(3)某发电厂每天排放1.12×103m3(标准状况)尾气,其中含0.02%(体积分数)的SO2,现欲用2.0 mol/L氢氧化钠溶液进行处理,每天至少需要氢氧化钠溶液的体积是______L.
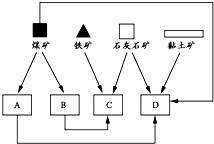
参考答案:(1)依据流程图分析判断,建立焦化厂、发电厂、水泥厂等,形成规模的工业体系,煤矿用来火力发电,也可以用来炼焦得到炼铁的还原剂,A为发电厂,B为炼焦厂,赤铁矿和石灰石用来炼铁和出脉石,C为炼铁出厂,D是粘土和石灰石为原料的工艺生成判断为水泥厂,故答案为:炼焦厂;水泥厂;
(2)①测出试样的质量(托盘天平),体积(量筒中加水再加入待测物),求出密度,两者密度差异大,故答案为:A、F;
②金在高温下不与氧气反应,硫铁矿可与氧气反应,4FeS2(s)+11O2(g)=2Fe2O3(s)+8SO2(g),可用酒精喷灯灼烧观察颜色的变化,故答案为:B、D;
(3)设需要氢氧化钠溶液的体积为x
NaOH+SO2═NaHSO3
122.4
2.0 mol/L×x1.12×103m3×1000×0.02%
12.0mol/L×x=22.41.12×103m3×1000×0.02%
解得:x=5L
故答案为:5.
本题解析:
本题难度:一般
4、选择题 化学与工农业生产、人类生活都有密切相关,下列说法中正确的是
A.CO2和CH4都是造成温室效应的气体
B.石油裂解、煤的气化、海水制镁等过程中都包含化学变化
C.铝合金的大量使用归功于人们能使用焦炭等还原剂从氧化铝中获得铝
D.海水中含有钾、钠元素,只需经过物理变化就可以得到钾和钠单质
参考答案:AB
本题解析:C选项,冶炼金属铝应是用电解法冶炼。D选项还需经过一系列的化学反应才能得到钾或钠的单质。
本题难度:一般
5、填空题 氨基磺酸(H2NSO3H)是一元固体强酸,溶于水和液氨,不溶于乙醇。在工业上用作酸性清洗剂、阻燃剂、磺化剂。用尿素[CO(NH2)2]和发烟硫酸(溶有SO3的硫酸)为原料合成氨基磺酸的路线如下:
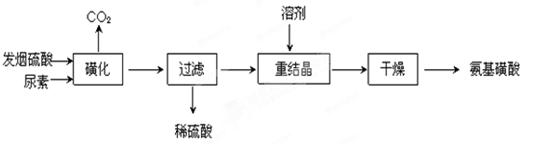
(1)重结晶用10%~12%的硫酸作溶剂而不用水作溶剂的原因是______________
(2)“磺化”步骤中所发生的反应为:
①CO(NH2)2(s) + SO3(g) 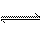 H2NCONHSO3H(s) △H<0
H2NCONHSO3H(s) △H<0
②H2NCONHSO3H + H2SO4 2H2NSO3H + CO2↑
2H2NSO3H + CO2↑
“磺化”过程应控制反应温度为75~80℃,若温度高于80℃,氨基磺酸的产率会降低,原因是_______________ 。
(3)测定产品中氨基磺酸纯度的方法如下:称取7.920g产品配成l000mL待测液,量取25.00mL待测液于锥形瓶中,加入2mL 0.2mol·L-1稀盐酸,用淀粉碘化钾试剂作指示剂,逐滴加入0.08000mol·L-1NaNO2溶液,当溶液恰好变蓝时,消耗NaNO2溶液25.00mL,此时氨基磺酸恰好被完全氧化成N2,NaNO2的还原产物也为N2。试求产品中氨基磺酸的质量分数?。
(4)以酚酞为指示剂,用NaOH进行酸碱中和滴定也能测定产品中氨基磺酸的纯度,测定结果通常比NaNO2法偏高,原因是氨基磺酸中混有___________杂质。
参考答案:(1)氨基磺酸在硫酸溶液中的溶解度比在水中的溶解度小。(2分)
(2)温度高,SO3气体逸出加 快
快 ,使反
,使反 应①转化率降低。温度高,反应①平衡向逆反应方向移动。(2分)
应①转化率降低。温度高,反应①平衡向逆反应方向移动。(2分)
(3)H2N SO3H+NaNO
SO3H+NaNO 2=NaHSO4+N2↑+H2O。或写出关系式H2NSO3H~NaNO2
2=NaHSO4+N2↑+H2O。或写出关系式H2NSO3H~NaNO2
n (H2NSO3H)=n(NaNO2)=25. 00×l0—3 × 0.08000 mol·L-1=2.000×l0—3 mol?ω(H2NSO3H)= 98.0%
mol·L-1=2.000×l0—3 mol?ω(H2NSO3H)= 98.0% (4分)
(4分)
(4)硫酸?(2分)
本题解析:略
本题难度:一般