1、填空题 [化学—选修化学与技术](15分)
通常情况下,当空气中CO2的体积分数超过0.050%时,会引起明显的温室效应。为减小和消除CO2对环境的影响,各国都在限制CO2的排量,同时也加强对CO2创新利用的研究。
(1)目前,推广用超临界CO2(介于气态和液态之问)代替氟利昂作致冷剂,这一做法对环境的积极意义是___________________。
(2)科学家为提取空气中的CO2,把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应使之变为可再生燃料甲醇。流程如下:
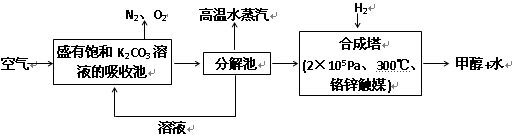
①分解池中反应的化学方程式为:_____________________________。
②合成塔中,若有4.4g CO2与足量H2恰好反应生成气态产物,放出4.947kJ的热量,写出该反应的热化学方程式:________________________。
(3)某同学拟用沉淀法测定空气中CO2的体积分数,他查得CaCO3、BaCO3的溶度积K(sp)分别为4.96×10-9、2.58×10-9。他最好将空气通入足量的__________溶液,实验时除测定温度、压强和空气的体积外,还需要测定_____________。
参考答案:(1)保护臭氧层(3分)
(2)①2KHCO3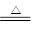 K2CO3+CO2↑+H2O(3分)
K2CO3+CO2↑+H2O(3分)
②CO2(g)+3H2(g)=CH3OH(g)+H2O(g);△H=-49.47kJ/mol(3分)
(3)Ba(OH)2(或NaOH和BaCl2混合溶液)(3分)?生成沉淀的质量(3分)
本题解析:
分析:(1)根据氟利昂能产生氯原子,而氯原子是臭氧分解的催化剂;
(2)①根据碳酸氢钾受热分解的化学性质回答;
②合成塔中发生反应为二氧化碳与氢气反应生成甲醇和水,根据4.4 kg CO2与足量H2恰好完全反应,可放出4 947 kJ的热量,则1 mol CO2与氢气合成甲醇放出热量49.47 kJ的热量.书写热化学反应方程式时还应注意物质状态、反应热的正负号以及单位;
(3)根据CaCO3、BaCO3的溶度积大小可知BaCO3更难溶,因此令CO2生成BaCO3反应更完全.
解答:解:(1)氟利昂在空气中能产生氯原子,而氯原子是臭氧分解的催化剂,CO2作致冷剂可防止臭氧层破坏,故答案为:保护臭氧层;
(2)①碳酸氢钾受热可分解成碳酸钾、二氧化碳和水,方程式为:2KHCO3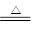 K2CO3+H2O+CO2↑,故答案为:2KHCO3
K2CO3+H2O+CO2↑,故答案为:2KHCO3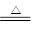 K2CO3+H2O+CO2↑;
K2CO3+H2O+CO2↑;
②根据4.4 kg CO2与足量H2恰好完全反应,可放出4 947 kJ的热量,则1 mol CO2与氢气合成甲醇放出热量49.47 kJ的热量,所以热化学方程式为CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-49.47kJ/mol,故答案为:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-49.47kJ/mol;
(3)根据CaCO3、BaCO3的溶度积大小可知BaCO3更难溶,因此令CO2生成BaCO3反应更完全,故可选择Ba(OH)2(或NaOH溶液和BaCl2溶液)作为CO2的沉淀剂,测定的数据除空气的体积外,还需要测定实验时的温度、压强、沉淀的质量,故答案为:Ba(OH)2(或NaOH溶液和BaCl2溶液);实验时的温度、压强、沉淀的质量.
点评:本题以对CO2创新利用的研究为载体,考查热化学方程式、沉淀剂选择等知识,难度中等,旨在考查学生对知识的掌握及迁移运用能力.
本题难度:一般
2、选择题 以下叙述不正确的是
[? ]
A.不锈钢是化合物
B.黄铜是合金
C.钛和钛合金是制造飞机轮胎的重要材料
D.铝是地壳中含量最多的金属元素
参考答案:A
本题解析:
本题难度:简单
3、填空题 A为药用有机物,从A出发可发生图3-1所示的一系列反应。已知A在一定条件下能跟醇发生酯化反应,A分子中苯环上的两个取代基连在相邻的碳原子上;D不能跟NaHCO3溶液反应,但能跟NaOH溶液反应。
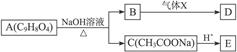
图3-1
试完成:
(1)A转化为B、C时,涉及到的反应类型有____________、____________。
(2)E的两种同分异构体Q、R都能在一定条件下发生银镜反应,R能跟金属钠反应放出氢气,而Q不能。Q、R的结构简式分别为:Q____________,R____________。
(3)气体X的化学式为____________,D的结构简式为____________。
(4)A在加热条件下与NaOH溶液反应的化学方程式为:________________________。
参考答案:(1)水解反应(或取代反应)?中和反应(或复分解反应)
(2)
(3)CO2?
(4)

本题解析:根据已知条件可知:A中有一个苯环,苯环上有两个邻位取代基,其中之一是羧基,加一官能团是酯基,再结合碱性条件下水解的产物乙酸钠,可知它是乙酸酚酯。则可写出A和B的结构式。
B中有酚钠和羧酸钠,而D中有酚羟基并无羧基,则说明酸化的物质其酸性介于酚与羧酸之间,它应该是由二氧化碳溶于水所产生的碳酸。
A分子又能消耗多少氢氧化钠呢?一个羧基消耗1个氢氧化钠,一个酚酯则可消耗两个氢氧化钠,所以1摩尔A共需消耗3摩氢氧化钠。
本题难度:简单
4、选择题 合金具有许多优良的性能.下列物质不属于合金的是( )
A.青铜
B.水银
C.碳素钢
D.黄铜
参考答案:B
本题解析:
本题难度:一般
5、填空题 (1)铝土矿的主要成分是Al2O3·3H2O,假设杂质是Fe2O3,写出由铝土矿制备金属铝的各步骤的化学方程式。(2013年高考题片段,源于高一教材)
(2)炼铁的原料有赤铁矿(假设杂质为SiO2)、焦炭、石灰石,设备为高炉,写出炼铁时所发生的主要的化学反应方程式?
(3)工业上用石英砂先煅烧制取粗硅,最后经过还原反应制取高纯硅,其反应方程式分别为:?
(4)假设没有Fe,生活会?
假设没有Al,生活会??
假设没有Si,生活会?
参考答案:(27分)方程式各2分,(4)问共3分
(1)①Al2O3+2NaOH=2NaAlO2+H2O?②NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
③2Al(OH)3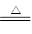 Al2O3+3H2O?④2Al2O3
Al2O3+3H2O?④2Al2O3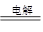 4Al+3 O2↑
4Al+3 O2↑
(2)①C+O2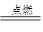 CO2?②CO2+C
CO2?②CO2+C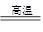 2CO?③Fe2O3+3CO
2CO?③Fe2O3+3CO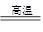 2Fe+3CO2
2Fe+3CO2
④CaCO3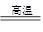 CaO+CO2↑?⑤CaO+SiO2
CaO+CO2↑?⑤CaO+SiO2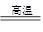 CaSiO3
CaSiO3
(3)①SiO2+2C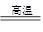 Si(粗硅)+2CO↑?②Si+2Cl2
Si(粗硅)+2CO↑?②Si+2Cl2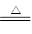 SiCl4
SiCl4
③SiCl4+2H2===Si(高纯硅)+4HCl
(4)合理答案都给分。没有Fe,过原始人的生活,没有Al,过封建社会生活,没有Si,没法过信息时代的生活。
本题解析:(1)铝土矿的主要成分是Al2O3·3H2O,杂质是Fe2O3,则提纯氧化铝时必须除去氧化铁。根据氧化铝两性氧化物可知,姜铝土矿溶解在氢氧化钠溶液中,氧化铝溶解,生成偏铝酸钠,过滤得到偏铝酸钠溶液。向偏铝酸钠中通入CO2即生成氢氧化铝沉淀,过滤即得到氢氧化铝。氢氧化铝分解生成氧化铝,电解氧化铝即得到金属铝。
(2)高炉炼铁时焦炭燃烧生成CO2,高温下碳和CO2反应又生成CO。生成的CO具有还原性,在高温下可以还原氧化铁。在高温下石灰石分解生成氧化钙和CO2,生成的氧化钙在高温下在和二氧化硅反应生成硅酸钙。
(3)石英砂的主要成分是二氧化硅,在高温下和二氧化硅反应生成粗硅。粗归和氯气在高温下反应生成四氯化硅,然后利用氢气还原四氯化硅置换出单质硅。
点评:该题是基础性试题的考查,试题基础性强,紧扣教材基础知识,有利于调动学生的学习兴趣,激发学生的学习积极性。也有利于培养学生的逻辑推理能力和规范的答题能力。
本题难度:一般