1、填空题 已知H2O2是一种弱酸,在强碱性溶液中主要以HO2— 形式存在。目前研究比较热门的Al-H2O2电池,其电池总反应为2Al+3HO2-=2AlO2-+OH-+H2O。现以Al—H2O2电池电解尿素[CO(NH2)2]的碱性溶液制备氢气(右池中隔膜仅阻止气体通过,b、c、d均为惰性电极)。试回答下列问题

电极b是 极,电极反应式为 ,
(2)右池是 池,电极c的电极反应式为 ,
(3)通电2min后,Al电极质量减轻2.7g,则产生氮气的体积为 。(标准状况)
参考答案:(10分)

正,HO2-+2e—+H2O=3OH—,
(2)电解,CO(NH2)2-6 e—+8OH—=CO32—+N2+ 6H2O(3)1.12L
本题解析:Al和b电极构成原是电池,Al活泼易失电子发生氧化反应作负极,b作正极;c和d电极构成电解池,c作阳极d作阴极,(1)电极b是正极,电极反应式为HO2-+2e—+H2O=3OH—;(2)右池是电解池,电极c作阳极,电极反应式为CO(NH2)2-6 e—+8OH—=CO32—+N2+ 6H2O (3)由电子守恒,2.7gAl失电子0.3mol,生成氮气0.3mol/6=0.05mol,在标况下的体积为1.12L 。
考点:原电池、电解池、燃料电池
本题难度:一般
2、填空题 (18分)金属镍(Ni)的应用越来越广泛。
(1)LiNiO2常用作锂离子电池的正极材料,负极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料。这种锂离子电池的电池反应式为:
xLi+Li1-xNiO2 LiNiO2
LiNiO2
LiNiO2中,Ni元素的化合价为?;充电时,LiNiO2中化合价发生变化的元素有?(填元素符号)
(2)Ni常被镀在金属制品上以保护金属不生锈。镀镍的方法有:
方法Ⅰ:?电镀镍。以NiSO4为电镀液。
① 待镀零件与电源?相连,金属镍板与电源?相连。
方法Ⅱ:化学镀。将待镀零件浸泡在含有Ni2+和H2PO2-的溶液中,在酸性等条件下发生下述反应:
(a)?Ni2+ + ??H2PO2-+ ??→??Ni +? + ??H2PO3-+ ?
(b)6H2PO2- + 2H+= 2P+ 4H2PO3-+ 3H2↑
上述反应可在塑料镀件表面沉积镍—磷合金,从而达到化学镀镍的目的。
② 请在答题卡上写出并配平反应式(a)。
③ 化学镀与电镀相比较,在原理上的相同点是:?。
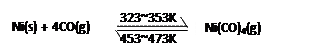 (3)Ni可以与CO(g)发生反应:
(3)Ni可以与CO(g)发生反应:
利用该反应可以提纯粗Ni,得到高纯度的金属Ni。
① 该反应的平衡常数表达式为?
② 生产中,在如图所示密闭容器中充入CO气体,粗Ni放置在?(填编号)
 A.低温区? B.高温区
A.低温区? B.高温区
参考答案:
(1)+3,Li、Ni?(4分)?(2)①负极,正极?(4分)
②2Ni2+ + 1H2PO2-+ 1H2O → 2 Ni+? +1H2PO3-+ 2 H+(4分)
③都利用氧化还原反应?(2分)?(3)① ?(2分)? ②A (2分)
本题解析:略
本题难度:简单
3、简答题 【化学与技术】
由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流程示意图如下:
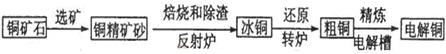
(1)在反射炉中,把铜精矿砂和石英砂混合加热到1000℃左右,黄铜矿与空气反应生成Cu和Fe的低价硫化物,且部分Fe的硫化物转化为低价氧化物。该过程中两个主要反应的化学方程式是?、?,反射炉内生成炉渣的主要成分是?;
(2)冰铜(Cu2S和FeS互相熔合而成)含Cu量为20%~50%。转炉中将冰铜加熔剂(石英砂)在1200℃左右吹入空气进行吹炼。冰铜中的Cu2S被氧化成Cu2O,生成的Cu2O与Cu2S反应,生成含Cu量约为98.5%的粗铜,该过程发生反应的化学方程式是?、?;
(3)粗铜的电解精炼如图所示。
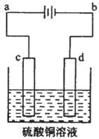
在粗铜的电解过程中,粗铜板是图中电极?(填图中的字母);在电极d上发生的电极反应为?;若粗铜中还含有Au、Ag、Fe,它们在电解槽中的存在形式和位置为?。
参考答案:(1)2CuFeS2+O2Cu2S+2FeS+SO2?2FeS+3O22FeO+2SO2,FeSiO3;
(2)2Cu2S+3O22Cu2O+2SO2?Cu2S + 2Cu2O6Cu + SO2↑
(3)c; Cu2++2e-=Cu; Au、Ag以单质的形式沉积在c(阳极)下方,Fe以Fe2+的形式进入电解质溶液中。
本题解析:(1)Cu和Fe的低价硫化物为Cu2S和2FeS,因此有2CuFeS2 +O2 Cu2S +2FeS+SO2?2FeS+3O2?
Cu2S +2FeS+SO2?2FeS+3O2? 2FeO+2SO2,反射炉内生成炉渣的主要成分是?FeSiO3,因为是炼铜的一个反应,所以为应该含有铜的硅酸盐。
2FeO+2SO2,反射炉内生成炉渣的主要成分是?FeSiO3,因为是炼铜的一个反应,所以为应该含有铜的硅酸盐。
(2)依题中提供的信息有:2Cu2S+3O2 2Cu2O+2SO2、? Cu2S+2Cu2O
2Cu2O+2SO2、? Cu2S+2Cu2O 6Cu+SO2↑
6Cu+SO2↑
(3)电解精炼铜时,阳极挂的是粗铜,阴极挂的是纯铜,电解质溶液是含有铜的盐,连接电池负极的是电解池的阴极,连接电池正极的是电解池的阳极。所以粗铜板是图中电极c;在电极d上发生的电极反应式为Cu2+ + 2e-= Cu;Au、Ag以单质的形式沉积在c(阳极)下方,形成所谓的“阳极泥”,Fe以Fe2+的形式进入电解质溶液中。
本题难度:一般
4、选择题 下图是工业电解饱和食盐水的装置示意图,下列有关说法不正确的是

A.装置中的离子交换膜只能让阳离子通过,不能让阴离子通过
B.装置中出口①处的物质是氢气,出口②处的物质是氯气
C.除去杂质后的氢氧化钠溶液从出口B处导出
D.转移电子0.8 mol时产生氢气8.96 L(标准状态)
参考答案:B
本题解析:电解饱和食盐水时溶液阳极产生的气体是氯气,阴极产生的气体是氢气,所以①处的物质是氯气,出口②处的物质是氢气,B正确;离子交换膜可以让阴阳离子通过,A错误;阴极产生的氢气和氢氧化钠所以氢氧化钠溶液从B处导出,根据电极反应方程式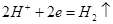 ,转移0.8moL电子时生成的氢气为0.4moL,体积为
,转移0.8moL电子时生成的氢气为0.4moL,体积为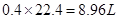 ,所以答案选B。
,所以答案选B。
本题难度:简单
5、填空题 电解原理在化学工业中有广泛应用。如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
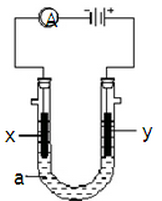
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
① 电解池中X极上的电极反应式为 。在X极附近观察到的现象是 。
② Y电极上的电极反应式为 ,检验该电极反应产物的方法是 。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
① X电极的材料是 ,电极反应式是 。
② Y电极的材料是 ,电极反应式是 。
(说明:杂质发生的电极反应不必写出)
参考答案:(1)① 2H++2e-=H2↑;放出气体,溶液变红② 2Cl
本题解析:
本题难度:一般