1、选择题 短周期元素A、B,若A离子与B离子电子层结构相同,且A离子半径大于B离子半径,则下列说法一定正确的是?(?)
A.原子半径A<B? B.电负性A<B
C.元素A、B不同周期? D.A原子序数小于B原子序数
参考答案:D
本题解析:电子层相同时,核电荷数越大半径越小,故A的原子序数相对小,D正确;而其它选项均不能确定正确
本题难度:简单
2、填空题 下列是部分短周期中第二、第三周期元素的原子半径及主要化合价。
元素代号
| ①
| ②
| ③
| ④
| ⑤
| ⑥
| ⑦
| ⑧
|
原子半径(nm)
| 0.186
| 0.160
| 0.152
| 0.143
| 0.110
| 0.099
| 0.075
| 0.074
|
主要化合价
| +1
| +2
| +1
| +3
| +5、-3
| +7、-1
| +5、-3
| -2
|
回答下列问题:
(1)⑥在元素周期表中的位置是(周期、族)?。
(2)在这8种元素的最高价氧化物的水化物中,酸性最强的是?(填化学式)。
(3)①⑥形成物质的电子式?
(4)写出④最高价氧化物对应水化物与⑥的氢化物水溶液反应的离子方程式:
??。
(5)下列叙述正确的是?(填字母)。
A.③、④处于不同周期?
B.②的阳离子与⑧的阴离子的核外电子数相等
C.⑥在同主族元素中非金属性最强?
D.⑤元素与⑦元素两者核电荷数之差是8
E.①与⑧形成的化合物具有两性
参考答案:(11分)(1)第三周期第VIIA族(2分) ?(2)HClO4?(2分)
(3)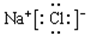 ?(2分)?(4)Al(OH)3 + 3H+= Al3+ + 3H2O?(2分) (5)A、B、D?(3分)
?(2分)?(4)Al(OH)3 + 3H+= Al3+ + 3H2O?(2分) (5)A、B、D?(3分)
本题解析:根据元素原子半径和主要化合价可知,①~⑧元素分别是Na、Mg、Li、Al、P、Cl、N、O。
(1)氯元素在元素周期表中的位置是第三周期第VIIA族。
(2)非金属性越强,最高价氧化物的水化物的酸性越强,则在这8种元素的最高价氧化物的水化物中,酸性最强的是H ClO4。
(3)①⑥形成物质是氯化钠,含有离子键的离子化合物,其电子式为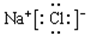 。
。
(4)④最高价氧化物对应水化物与⑥的氢化物水溶液反应的离子方程式Al(OH)3 + 3H+= Al3+ + 3H2O。
(5)⑥在同主族元素中非金属性不是最强的,最强的是F,C不正确;①与⑧形成的化合物是氧化钠或过氧化钠,不具有两性,E不正确,其余选项都是正确的,答案选ABD。
点评:该题是高考中的常见考点,属于基础性试题的考查。侧重对学生基础知识的巩固与训练,有助于培养学生的逻辑推理能力。本题主要是元素“位、构、性”三者关系的综合考查,比较全面考查学生有关元素推断知识和灵活运用知识的能力。该题以“周期表中元素的推断”为载体,考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。
本题难度:一般
3、选择题 据报道,上海市某医院正在研究用放射性同位素12553I治疗肿瘤。该同位素原子核内的中子数与核外电子数之差为?
A.19
B. 53
53
C.72
D.125
参考答案:A
本题解析:略
本题难度:简单
4、选择题 在元素周期表中金属与非金属的分界处,可以找到(? )
A.合金
B.半导体材料
C.催化剂
D.农药
参考答案:B
本题解析:金属元素的单质容易导电,而非金属元素的单质不容易导电,因此在元素周期表中金属与非金属的分界处,可以找到半导体材料,因此选项是B。
本题难度:简单
5、选择题 下表是X、Y、Z三种元素的单质的某些性质:
元素
| 熔点/℃
| 沸点/℃
| 与水的反应
| 导电性
|
X
| -209.9
| -195.8
| 不反应
| 不导电
|
Y
| -219.6
| -188.1
| 形成酸性溶液
| 不导电
|
Z
| 180.5
| 1347
| 形成碱性溶液
| 导电
|
若X、Y、Z这三种元素属于周期表中的同一周期,则它们的原子序数递增的顺序是(?)
A.X、Y、Z
B.Z、X、Y
C.Y、X、Z
D.Z、Y、X
参考答案:B
本题解析:由表中数据知Y是非金属性强的非金属元素(如F、Cl、Br等),Z是金属性强的金属元素(如Na、K、Rb、Ca等),因X、Y、Z同周期,则原子序数Z<X<Y。
本题难度:简单