1、选择题 将钠、镁、铝各0.3mol分别放入100mL的1mol/L的盐酸中充分反应,生成的气体在同温、同压下的体积比是(?)
A.1:2:3
B.6:3:2
C.3:1:1
D.1:1:1
参考答案:C
本题解析:很明显看出镁铝与酸反应中均过量,产生的氢气相同均为0.05mol,而钠除与酸反应外还可与水反应,最终可得到0.15mol氢气,再由阿伏加德罗定律可知,钠、镁、铝三金属生成的气体比为:3:1:1,答案为C
本题难度:一般
2、选择题 有五瓶溶液分别是:①10 mL 0.6 mol/L NaOH溶液;②20 mL 0.5 mol/L H2SO4溶液;③30 mL 0.4 mol/L HCl溶液;④40 mL 0.3 mol/L CH3COOH溶液;⑤50 mL 0.2 mol/L蔗糖溶液。以上各瓶溶液所含离子、分子总数的大小顺序是?(?)
A.①>②>③>④>⑤
B.②>①>③>④>⑤
C.②>③>④>①>⑤
D.⑤>④>③>②>①
参考答案:D
本题解析:题目要求各瓶溶液所含离子、分子总数的大小顺序,特别注意有分子总数,在上述溶液中水分子的多少决定粒子总数多少,水分子总数⑤>④>③>②>①,故选D。
本题难度:一般
3、选择题 在常温常压下的以下物质①10mL水②100mL氯气③220mL氖④120mL二氧化碳,这四种物质中所含原子数由多到少的顺序是?
A.①②③④
B.①④③②
C.③④②①
D.④③②①
参考答案:B
本题解析:
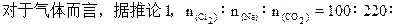
120,原子数之比:100×2∶220∶120×3=200∶220∶360。所以三者由多到少顺序为④③②,①中水为液态,其物质的量远远大于其余三种,故B项符合题意。
本题难度:一般
4、选择题 下列溶液中Cl-的物质的量浓度最小的是
A.200mL 2mol/L MgCl2溶液
B.1000mL 2.5mol/L NaCl溶液
C.250mL 1mol/L AlCl3溶液
D.300mL 5mol/L KClO3溶液
参考答案:D
本题解析:A项:Cl-的物质的量浓度是4mol/L;B项:Cl-的物质的量浓度是2.5mol/L;C项:Cl-的物质的量浓度是3 mol/L;D项:Cl-的物质的量浓度是15mol/L。故选D。
点评:本题考查学生有关物质的量的相关计算知识,可以根据所学内容来回答,较简单。
本题难度:一般
5、选择题 将V1L0.1 mol·L-1K2SO4溶液、V2L0.2mol·L-1Al2(SO4)3和V3 L H2O混合,欲使混合液中K+、Al3+、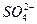 的物质的量浓度分别为:0.1 mol·L-1、0.1 mol·L-1、0.2 mol·L-1,则所取溶液的体积比是(忽略溶液混合带来总体积的变化(?)
的物质的量浓度分别为:0.1 mol·L-1、0.1 mol·L-1、0.2 mol·L-1,则所取溶液的体积比是(忽略溶液混合带来总体积的变化(?)
A.1∶1∶1
B.2∶1∶2
C.1∶1∶2
D.2∶1∶1
参考答案:D
本题解析:由题意:
①0.1? mol·L-1·V1L×2=0.1? mol·L-1×(V1L+V2L+V3L)(K+守恒)
②0.2? mol·L-1×V2L×2=0.1? mol·L-1×(V1L+V2L+V3L)(Al3+守恒)
③0.1? mol·L-1×V1L+0.2 mol·L-1×(V2L×3)=0.2? mol·L-1×(V1L+V2L+V3L)( 守恒)
守恒)
由①②解得V1=2V2,排除A、C选项;将B选项中数据代入①(或②或③),不正确,排除B选项。
本题难度:简单