1、填空题 (8分)二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。比Cl2更好。
⑴在ClO2的制备方法中,有下列两种制备方法:
方法一:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
方法二:2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+O2↑ +2H2O
+2H2O
用方法二制备的ClO2更适合用于饮用水消毒,其主要原因是?。
⑵用ClO2处理过的饮用水(pH 5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(ClO2-)。
饮用水中的ClO2、ClO2-含量可用连续碘量法进行测定。ClO2被I-还原为ClO2-、Cl-的转化率与溶液pH的关系如下图所示。当pH≤2 .0时,ClO2-也能被I-完全还原为Cl-。反应生成的I2用标准Na2S2O3溶液滴定;2Na2S2O3+ I2= Na2S4O6 + 2NaI
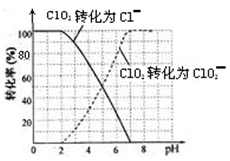
①请写出pH≤2 .0时ClO2--与I-反应的离子方程式?。
②请完成相应的实验 步骤:
步骤:
步骤1:准确量取V mL水样加入到锥形瓶中。
步骤2:调节水样的pH为7.0~8.0。
步骤3:加入足量的KI晶体。
步骤4:加入少量淀粉溶液,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V1mL。
步骤5:?。
步骤6:再用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2?mL。
③根据上述分析数据,测得该饮用水中ClO2-的浓度为? ?mol·L-1(用含字母的代数式表示)。
?mol·L-1(用含字母的代数式表示)。
参考答案:(8分)⑴方法 二制备的ClO2中不含Cl2(2分)
二制备的ClO2中不含Cl2(2分)
⑵①ClO2-+4H++4I-=Cl-+2I2+2H2O(2分)
②调节溶液的pH≤2.0(2分)?③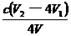 (2分)
(2分)
本题解析:略
本题难度:一般
2、实验题 (12分)某化学活动小组设计如下图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与Na2CO3反应得到的固体物质。
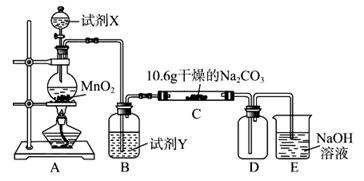
(1)写出装置A中发生反应的化学方程式:?。
(2)写出试剂Y的名称:??。
(3)已知:通入一定量的氯气后,测得D中只有一种常温下为黄红色的气体,其为含氯氧化物。可以确定的是C中含有的氯盐只有一种,且含有NaHCO3,现对C成分进行猜想和探究。
①提出合理假设。
假设一:存在两种成分: NaHCO3和?;
假设二:存在三种成分: NaHCO3和?、?。
②设计方案,进行实验。请写出实验步骤以及预期现象和结论(可不填满)。
限选实验试剂和仪器:蒸馏水、稀硝酸、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯。
实验步骤
| 预期现象和结论
|
步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中。
| ?
|
步骤2:
| ?
|
步骤3:
| ?
|
(4)已知C中有0.1 mol Cl2参加反应。若假设一成立,可推知C中反应的化学方程式为?。
参考答案:(12分)(1)4HCl(浓)+MnO2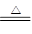 MnCl2+Cl2↑+2H2O (2分)
MnCl2+Cl2↑+2H2O (2分)
(2)饱和食盐水(或饱和氯化钠溶液) (1分)
(3)①假设一:NaCl (1分)
②假设二:NaCl? Na2CO3(2分)
 (每空1分)
(每空1分)
(3)2Cl2+2 Na2CO3+H2O ="=" 2NaHCO3+2NaCl+Cl2O (2分)
本题解析:(1)装置A是制取氯气的,所以反应的方程式是
4HCl(浓)+MnO2 MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
(2)由于生成的氯气中含有挥发出的氯化氢,而氯化氢也能与碳酸钠反应。所以装置B中的试剂是除去氯气中的氯化氢气体的,因此试剂是饱和食盐水(或饱和氯化钠溶液) 。
(3)①在反应中氯气既是氧化剂,也是还原剂,所以一定有氯化钠生成,即假设一就是碳酸氢钠和氯化钠;又因为碳酸钠在反应中可能是过量的,所以假设二就是含有氯化钠、碳酸钠和碳酸氢钠。
②碳酸钠的检验可以利用氯化钡。而氯化钠的检验可以利用硝酸酸化的硝酸银溶液。
(4)0.1mol氯气生成0.1mol氯化钠,转移0.1mol电子。根据电子得失守恒可知,氧化产物中氯元素的化合价应该是+1价,即化合物是Cl2O ,所以反应的方程式是2Cl2+2 Na2CO3+H2O ="=" 2NaHCO3+2NaCl+Cl2O。
本题难度:一般
3、填空题 实验室可以用高锰酸钾和浓盐酸反应制取氯气,反应的化学方程式如下:
2KMnO4 + 16HCl(浓)=" 2KCl" + 2MnCl2 + 5Cl2↑ + 8H2O
(1)在该反应中,氧化剂是?,还原剂是?。
(2)当有0.10mol电子发生转移时,生成氯气的体积为?(标准状况),发生反应的KMnO4的质量为?。
参考答案:
本题解析:略
本题难度:简单
4、填空题 请回答下列实验室中制取气体的有关问题。
(1)如图是用KMnO4与浓盐酸反应制取适量氯气的简易装置。
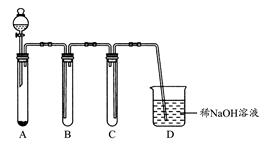
装置B,C,D的作用分别是:B?;C?;D?。
(2)在实验室欲制取适量NO气体。
①下图中最适合完成该实验的简易装置是?(填序号);
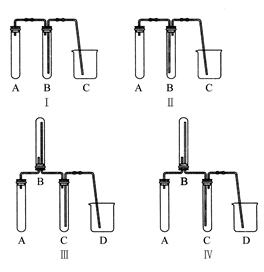
②根据所选的装置完成下表;(不需要的可不填)
?
③简单描述应观察到的实验现象?。
参考答案:(1)向上排气收集氯气 安全作用,防止D中的液体倒吸进入集气管B中 吸收尾气,防止氯气扩散到空气中污染环境
(2)①Ⅰ
②
?
应加入的物质
所起的作用
A
铜屑和稀硝酸
发生NO气体
B
水
排水收集NO气体
C
?
主要是接收B中排出的水
D
?
?
?
③反应开始时,A中铜表面出现无色小气泡,反应速率逐渐加快 A管上部空间由无色逐渐变为浅棕红色,随反应的进行又逐渐变为无色 A中的液体由无色变为浅蓝色 B中的水面逐渐下降,B管中的水逐渐流入烧杯C中
本题解析:(1)因氯气的密度比空气大,所以收集氯气时可用向上排空气法,装置B中导管是长进短出,装置C中导管是短进长出,则B,C装置能用于收集氯气的只能是装置B。装置D中盛有的稀NaOH溶液,能够吸收Cl2及挥发出的HCl。(2)实验室中可用铜与稀硝酸制取NO,因NO极易被氧化,所以收集NO不能用排空气法,应用排水法收集,可选用图I作制取NO气体的简易装置。A为NO的发生装置,加入的物质为铜屑和稀硝酸;B为排水法收集NO气体的装置,加入的物质为水;C主要是接收B中排出的水。
本题难度:简单
5、填空题 (12分)A~G各物质间的关系如下图,其中B、D为气态单质。
MnO2①Fe点燃
MnO2②△
请回答下列问题:
(1)物质C和E的名称分别为________、________;
(2)可选用不同的A进行反应①,若能在常温下进行,其化学方程式___________;
若只能在加热情况下进行,则反应物A应为________;
(3)反应②的化学方程式为_____________________;
(4)新配制的F溶液应加入________以防止其转化为G。检验G溶液中阳离子的常用试剂
是________,实验现象为_____________________________。
参考答案:(9分)(1) __浓盐酸_、_四氧化三铁__;
(2) _2H2O22H2O+O2↑_;?_ KClO3_;
(3) 4HCl(浓)+MnO2MnCl2+2H2O+Cl2↑;(2分)
(4) _铁粉__ _ KSCN(或NH4SCN)溶_, __溶液变红_
本题解析:略
本题难度:一般