1、选择题 .我国稀土资源丰富。下列有关稀土元素 与
与 的说法正确的是
的说法正确的是
A. 与
与 互为同位素
互为同位素
B. 与
与 的质量数相同
的质量数相同
C. 与
与 是同一种核素
是同一种核素
D. 与
与 的核外电子数和中子数均为62
的核外电子数和中子数均为62
参考答案:A
本题解析:质子数相同,中子数不同的核素称为同位素,具有一定数目质子数和中子数的原子成为核素。 与
与 质量数不同,B错;
质量数不同,B错; 与
与 是不同核素,C错;
是不同核素,C错; 与
与 的中子数不同, D错。
的中子数不同, D错。
本题难度:一般
2、选择题 短周期元素X、Y、Z原子序数之和为28,X+与Z2-具有相同的核外电子层结构,Y、Z在同一周期。下列推测正确的是
A.元素Y的最高化合价为+7
B.三种元素的原子半径rZ>rY>rX
C.Z的单质比Y的单质更易与H2反应
D.化合物X2Z2中阴阳离子数之比为1: 2
参考答案:D
本题解析:据题意推出X为钠元素、Y为氟元素、Z为氧元素;A项氟元素无正价,错误;B项三种元素的原子半径大小应该为rX>rZ>rY,错误;C项Z的单质比Y的单质更难与H2反应,错误;D项在Na2O2中阴阳离子数之比为1: 2,正确。
本题难度:一般
3、选择题 根据表1信息,判断以下叙述正确的是(? )
表1?部分短周期元素的原子半径及主要化合价
元素代号
| L
| M
| Q
| R
| T
|
原子半径/nm
| 0.160
| 0.143
| 0.112
| 0.104
| 0.066
|
主要化合价
| +2
| +3
| +2
| +6、—2
| —2
|
A.氢化物的沸点为H2T<H2R
B.M、Q元素的金属性? L<Q
C.工业上通过电解L与T形成的化合物生产单质L
D.离子半径:R2->T2->L2+>M2+
参考答案:D
本题解析:根据元素的主要化合价和原子半径可知,L是Mg。M是Al,Q是Be,R是S,T是O。水分子中含有氢键,沸点高于硫化氢的,A不正确。镁的金属性强于铝的,B不正确。工业水冶炼镁,用的原料是氯化镁,C不正确。所以选项D正确,答案选D。
本题难度:一般
4、填空题 己知X、Y、Z、W、N、U、V是短周期的主族元素,原子序数依次增大。X与N同主族,且与W都能形成A2B、A2B2型化合物;Z、W的单质常温下均为无色气体;Y原子的L层电子数是K层电子数的2倍;U原子的最外层电子数是其电子层数的2倍,试回答下列问题:
(1)YW2的电子式?;Z的氢化物结构式为?;写出U元素在周期表中的位置?。
(2)原子半径:U?V(填>、<或=,下同);气态氢化物的水溶液的酸性:U?V。
(3)写出UW2与V元素的单质在水溶液中反应的化学方程式是?。
(4)由X、Z组成的一种化合物化学式为ZX5,其各原子均达到同周期稀有气体原子的稳定结构,该物质属于?(填“离子”或“共价”)化合物。
(5)X、Y、Z、W四种元素(按顺序)可组成原子个数比为5:1:1:3的化合物,该化合物的稀溶液与足量氢氧化钠溶液在加热条件下反应的离子方程式为:?。
参考答案:(1) ;
;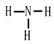 ;第三周期第ⅥA族。
;第三周期第ⅥA族。
(2)>;<。
(3)SO2+Cl2+2H2O=H2SO4+2HCl。
(4)离子。
(5)NH4++HCO3-+2OH- NH3↑+ CO32-+2H2O。
NH3↑+ CO32-+2H2O。
本题解析:根据题意可知这几种元素分别是X:H;Y是C;Z是N;W是O;N是Na;U是S;V是Cl. (1)CO2的电子式为 ;Z的氢化物即NH3的结构式为
;Z的氢化物即NH3的结构式为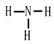 ;S是16号元素,核外电子排布为2、8、6,所以Cl元素在周期表中的位置是位于第三周期第ⅥA族。(2)S、Cl是同一周期的元素,由于原子序数Cl>S.原子序数越大,原子的半径就越小。因此原子半径:S>Cl. 气态氢化物的水溶液的酸性H2S是弱酸。HCl是强酸。因此酸性HCl>H2S。(3)SO2有还原性,而Cl2有氧化性,二者在溶液中发生氧化还原反应,方程式为:SO2+Cl2+2H2O=H2SO4+2HCl。(4)由X、Z组成的一种化合物化学式为NH5,其各原子均达到同周期稀有气体原子的稳定结构,该物质结构式为NH4H,属于离子化合物。(5)X、Y、Z、W四种元素(按顺序)可组成原子个数比为5:1:1:3的化合物是NH4HCO3,该化合物是弱酸的酸式盐,其稀溶液与足量氢氧化钠溶液在加热条件下反应的离子方程式为(5)NH4++ HCO3-+ 2OH-
;S是16号元素,核外电子排布为2、8、6,所以Cl元素在周期表中的位置是位于第三周期第ⅥA族。(2)S、Cl是同一周期的元素,由于原子序数Cl>S.原子序数越大,原子的半径就越小。因此原子半径:S>Cl. 气态氢化物的水溶液的酸性H2S是弱酸。HCl是强酸。因此酸性HCl>H2S。(3)SO2有还原性,而Cl2有氧化性,二者在溶液中发生氧化还原反应,方程式为:SO2+Cl2+2H2O=H2SO4+2HCl。(4)由X、Z组成的一种化合物化学式为NH5,其各原子均达到同周期稀有气体原子的稳定结构,该物质结构式为NH4H,属于离子化合物。(5)X、Y、Z、W四种元素(按顺序)可组成原子个数比为5:1:1:3的化合物是NH4HCO3,该化合物是弱酸的酸式盐,其稀溶液与足量氢氧化钠溶液在加热条件下反应的离子方程式为(5)NH4++ HCO3-+ 2OH- NH3↑+ CO32-+2H2O。
NH3↑+ CO32-+2H2O。
本题难度:一般
5、选择题 短周期元素分别为X、Y和Z,已知X元素的原子最外层只有1个电子,Y元素原子的M电子层上的电子数是它的K层和L层电子总数的一半,Z元素原子的L层上的电子数比Y元素原子的L电子层上的电子数少2个,则三种元素所形成的化合物的分子式不可能是(? )
A.X2YZ4
B.XYZ3
C.X3YZ4
D.X4Y2Z7
参考答案:A
本题解析:X元素的原子最外层只有1个电子,为ⅠA族元素,Y元素原子的M电子层上的电子数是它的K层和L层电子总数的一半,为P元素;Z元素原子的L层上的电子数比Y元素原子的L电子层上的电子数少2个,为O元素。
本题难度:简单