1、选择题 装置如图,通电后,发现Cu极附近溶液蓝色加深。下列说法正确的是
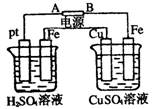
A.A极为负极,Cu为阳极
B.左烧杯溶液和右烧杯溶液pH都变小
C.左烧杯Pt极和右烧杯Fe极的电解产物物质的量之比为1∶1
D.左烧杯溶液浓度变大,右烧杯溶液浓度不变
参考答案:D
本题解析:略
本题难度:简单
2、选择题 下列装置或操作不能达到实验目的是(双选?)( )
A.
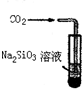
比较H2CO3和H2SiO3酸性强弱
B.
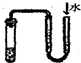
检查装置的气密性
C.

电解制Cl2和H2
D.

构成锌铜原电池
参考答案:CD
本题解析:
本题难度:一般
3、选择题 下列叙述正确的是
A.原电池中阳离子向负极移动
B.白铁(镀锌)的表面一旦破损,铁腐蚀加快
C.用铝质铆钉铆接铁板,铁易被腐蚀
D.马口铁(镀锡)的表面一旦破损,铁腐蚀加快
参考答案:D
本题解析:原电池中阳离子向正极移动,A不正确。由于锌的金属性强于铁的,所以白铁(镀锌)的表面一旦破损,发生电化学腐蚀时,铁是正极,锌是负极,锌被腐蚀,B不正确。用铝质铆钉铆接铁板,一旦形成原电池时,铁是正极,铝是负极,被腐蚀,C不正确。铁的金属性强于锡的,所以在选项D中,如果腐蚀电化学腐蚀,铁是负极,被腐蚀,D正确,答案选D。
本题难度:一般
4、填空题 为了探究原电池的电极名称不仅与电极材料有关还与电解质溶液有关,某学生做了如下的实验
编号
| 电极材料
| 电解质溶液
| 电子流向
|
①
| Mg—Al
| HNO3(浓)
| Mg→Al
|
②
| Mg—Al
| HCl(aq)
| Mg→Al
|
③
| Mg—Al
| NaOH(aq)
| Al→Mg
|
④
| Al—Cu
| HNO3(浓)
| Cu→Al
|
根据以上表格内容回答:
(1)实验1中Mg作___________(填正极或负极),发生__________(氧化反应或还原反应)
实验3中Mg作___________,发生__________(同上)
(2)实验2中Mg电极反应式为__________________。Al电极上的电极反应式为_________________________,总的电池反应是______________________________。
参考答案:(10分)(1)负极?氧化反应?正极?还原反应
(2)Mg -2e-=Mg2+? 2H+ + 2 e-=H2↑? Mg + 2H+=Mg2+ +H2↑
本题解析:(1)根据电子的流向可知,实验1中镁是负极,失去电子,发生氧化反应。而在实验3中铝是负极,失去电子,发生氧化反应。而镁是正极,发生还原反应。
(2)实验2中镁是负极,失去电子,电极反应式是Mg -2e-=Mg2+。铝是正极,溶液中的氢离子得到电子,电极反应式是2H+ + 2 e-=H2↑,因此总的反应式是Mg + 2H+=Mg2+ +H2↑。
点评:原电池中一般是活泼的金属作负极,不活泼的金属作正极。但在实际判断中,还需要考虑到电解质溶液,例如镁比铝活泼,如果盐酸是电解质溶液,则镁是负极,铝是正极。如果氢氧化钠溶液是电解质溶液,则铝是负极,镁是正极。因此在具体问题中还需要具体分析,灵活运用,且不可生搬硬套。
本题难度:一般
5、填空题 铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式____。
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式。正极反应____,负极反应____。
参考答案:(1)2Fe3+ +Cu=2Fe2+ +Cu2+
(2)装置如图: 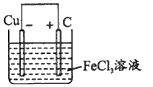
2Fe3+ +2e- =2Fe2+? ;Cu= Cu2+ + 2e- (或Cu-2e- = Cu2+ )
本题解析:
本题难度:一般