1、选择题 短周期金属元素甲~戊在元素周期表中的相对位置如表所示,
下面判断正确的是
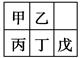
A.氢氧化物碱性:丙>丁>戊
B.金属性:甲>丙
C.原子半径: 丙<丁<戊
D.最外层电子数:甲>乙
参考答案:A
本题解析:在周期表中,同一周期的元素,随着原子序数的增加,元素的金属性逐渐减弱,氢氧化物碱性逐渐减弱,即丙>丁>戊,正确;原子半径逐渐减小,C错误;最外层电子数增多,D错误;同一主族的元素,随着元素原子序数的增加,元素的金属性逐渐减弱,B错误;
本题难度:一般
2、选择题 下列各项比较中,不正确的是
A.原子半径:Na<Mg<Al
B.与酸反应放出氢气的剧烈程度:K<Na<Li
C.氧化性:Si>N>O
D.气态氢化物的稳定性:HF>HCl>H2S
参考答案:ABC
本题解析:熟悉元素周期律的规律即可;
本题难度:一般
3、填空题 (9分)下表列出了①~⑦七种元素在周期表中的位置:

请按要求回答下列问题。
(1) 元素④的原子结构示意图是?。
(2) 元素③与⑥形成的化合物中的化学键类型为?。元素①与⑤形成的化合物的电子式为?。
(3) 在相同条件下,元素②、③、④的单质分别与盐酸反应最缓慢的是(填写化学式)?;这三种元素最高价氧化物对应水化物中碱性最强的是(填写化学式)?;
(4)元素⑤、⑥、⑦的单质氧化性依次(填写“增强”或“减弱”)?,它们的气态氢化物中稳定性最弱的是(化学式)?。
(5)将一小块元素②的单质放在石棉网上,用酒精灯微热,待其熔成球状时,将盛有元素⑥单质的集气瓶迅速倒扣在它的上方。写出该反应的化学方程式?。
参考答案:(1)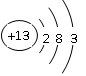
(2)离子键;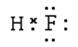 ;
;
(3)Al? NaOH
(4)减弱? HBr
(5)2Na+Cl2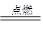 2NaCl
2NaCl
本题解析:考查元素周期表的结构和元素周期律的应用。根据元素在周期表中的位置可得出,①是H、②是Na、③是Mg、④是Al、⑤是F、⑥是Cl、⑦是Br。
(1)Al的原子序数是13,所以原子结构示意图为 。
。
(2)镁和氯都是活泼的金属和非金属,形成的化学键是离子键。H和F都属于非金属,形成的化学键是极性键,电子式为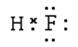 。
。
(3)同周期元素自左向右金属性逐渐减弱,所以Al和盐酸反应最缓慢、NaOH的碱性最强。
(4)同主族元素自上而下非金属性逐渐减弱,所以元素⑤、⑥、⑦的单质氧化性依次减弱,气态氢化物中稳定性最弱的是HBr。
(5)在加热时钠和氯气发生化合,生成离子化合物NaCl。
本题难度:一般
4、选择题 已知短周期元素的离子aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述中正确的是(?)
A.离子半径:C>D>B>A
B.原子序数:d>c>b>a
C.原子半径:A>B>C>D
D.单质的还原性:A>B>D>C
参考答案:A
本题解析:aA2+、bB+、cC3-、dD-都具有相同电子层结构,则A、B在下一周期,为金属元素,且原子序数A>B,C、D在上一周期,为非金属元素,且原子序数D>C,A、具有相同电子排布的离子,原子序数大的离子半径小,原子序数为A>B>D>C,则离子半径为C3->D->B+>A2+,故A正确;B、由电子层数越多的原子序数越大,同周期从左向右原子序数在增大,所以原子序数为a>b>d>c,故B不正确;C、电子层越多,半径越大,同周期原子序数越大,半径越小,则原子半径为B>A>C>D,故C不正确;D、由同周期从左向右元素的金属性在减弱,非金属性在增强,金属性为B>A>C>D,则单质的还原性B>A>C>D,故D错误;故选BA。
本题难度:一般
5、选择题 镭是周期表中第七周期第ⅡA族元素,下列关于镭的性质描述中,不正确的是(?)
A.镭比钙的金属性更强
B.单质能与水反应,放出氢气
C.其氢氧化物呈两性
D.其碳酸盐难溶于水
参考答案:C
本题解析:根据元素周期律,同主族元素从上往下,金属性依次增强,非金属性依次减弱,这是同主族元素的递变性。而同主族元素化学性质由于最外层电子相同,又具有相似性。所以,要推断镭的化学性质,可以参考钙和镁这些已经介绍过的元素的化学性质。
A正确,镭在钙的下面,金属性根据元素周期律可推断镭比钙强。
B正确,金属镁可与热水反应放出氢气,镭的金属性比镁强,所以也可以与水反应放出氢气。
C错误,金属钙,镁都不具备两性,镭的金属性比它们都强,所以也不具备两性。
D正确,参考碳酸钙,碳酸镁都是难溶于水,镭的碳酸盐根据同族元素性质的形似,可推断可能也是难溶于水。
本题难度:一般