1、选择题 下列说法正确的是?
A.在周期表中,族序数都等于该元素的最外层电子数.
B.非金属性最强的元素,其氢化物溶于水的酸性最强
C.碱金属随原子序数增大,熔点降低;卤族元素的单质,随原子序数增大,熔点依次升高.
D.同一周期的主族元素,从左至右,原子半径减小,它们所形成的简单离子半径从左至右依次增大
参考答案:C
本题解析:
主族序数等于该元素的最外层电子数,副族和零族例外,例如,铁原子最外层只有2个电子,但它位于第VIII族,A选项错误;非金属性最强的元素是氟,氟化氢是弱酸,B选项错误;碱金属固态单质为金属晶体,随原子序数增大,金属键减弱,晶体熔点降低;卤素单质是分子晶体,随着相对分子质量增大,分子间作用力增大,熔点升高,C选项正确;同一周期的主族元素,从左至右,简单阳离子半径逐渐减小,而简单阴离子半径比对应的原子半径要大。例如,S2->Cl->Na+>Mg2+>Al3+,D选项错误。
本题难度:一般
2、选择题 下列叙述正确的是
A.同周期元素的原子半径以VIIA族的为最大
B.同主族元素两种元素原子的核外电子数的差值可能为26
C.短周期元素中次外层电子数是最外层电子数2倍的原子一定是非金属元素
D.科学家在周期表中金属与非金属的分界线处找到了优良的催化剂
参考答案:B
本题解析:A、同周期元素的原子半径以IA族的为最大,错误;B、同主族元素两种元素原子的核外电子数的差值可能为26,第一、二主族的元素与其相隔一个周期的同族元素之间满足核外电子数的差值可能为26,正确;C、短周期元素中次外层电子数是最外层电子数2倍的原子不一定是非金属元素,如Li为金属元素,错误;D、科学家在周期表中金属与非金属的分界线处找到了优良的半导体材料,错误,答案选B。
本题难度:一般
3、填空题 (9分)下表是元素周期表的一部分:
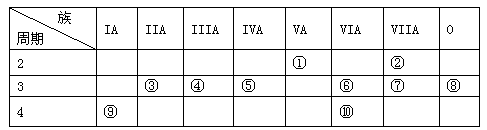
针对表中的①~⑩号元素,用元素符号或化学式填空:
(1)在这些元素中,最易失电子的元素是 ,非金属性最强的元素是 。
(2)化学性质最不活泼的元素是 ,其原子结构示意图为 。
(3)元素的最高价氧化物对应的水化物中呈两性的氢氧化物与氢氧化钠溶液反应的离子方程式是?。
(4)在②⑤⑦⑨四种元素中,原子半径由大到小的顺序是? ?。
(5)元素⑥、⑩的最高价氧化物对应的水化物中,酸性较强的是?。
参考答案:(1)K(1分)? F(1分)?(2)Ar(1分) 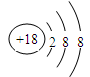 ?(1分)
?(1分)
(3)Al(OH)3+OH-=[Al(OH)4]-(2分) ?(4)K>Si>Cl>F (2分)?(5)H2SO4(1分)
本题解析:根据元素在周期表中的相对位置可知①~⑩号元素分别是N、F、Mg、Al、Si、S、Cl、Ar、K、Se。则
(1)同周期自左向右金属性逐渐减弱,非金属性逐渐增强,同主族自上而下金属性逐渐增强,非金属性逐渐减弱,则在这些元素中,最易失电子的元素是K,非金属性最强的元素是F。
(2)化学性质最不活泼的元素是稀有气体元素Ar,其原子结构示意图为 。
。
(3)元素的最高价氧化物对应的水化物中呈两性的氢氧化物是氢氧化铝,与氢氧化钠溶液反应的离子方程式是Al(OH)3+OH-=[Al(OH)4]-。
(4)同周期自左向右原子半径逐渐减小,同主族自上而下原子半径逐渐增大,则在②⑤⑦⑨四种元素中,原子半径由大到小的顺序是K>Si>Cl>F。
(5),同主族自上而下非金属性逐渐减弱,最高价氧化物对应水化物的酸性逐渐减弱,则元素⑥、⑩的最高价氧化物对应的水化物中,酸性较强的是H2SO4。
本题难度:简单
4、填空题 A、B、C 、D、E、F、G、H是元素周期表中八种原子序数依次增大的短周期元素。
、D、E、F、G、H是元素周期表中八种原子序数依次增大的短周期元素。
①A元素的原子半径在周期表中最小
②B元素的原子最外层电子数是次外层电子数的两倍
③C元素的最高价氧化物的水化物和氢化物反应生成盐
④D元素和E元素可以形成E2D、E2D2两种离子化合物
⑤G与D两种元素同主族,F、G、H三种元素同周期
⑥F元素是同周元素中离子半径最小的元素,H元素是同周期元素中原子半径最小的元素
(1)写出A、D、E三种元素形成的化合物的电子式?;
(2)用惰性电极电解由E与H两元素形成的化合物的水溶液,其化学方程式为?;
(3)八种元素中任意三种组成的易溶于水的酸性物质,能促进水电离的是?,能抑制水 电离的是?(各写一种化学式);
电离的是?(各写一种化学式);
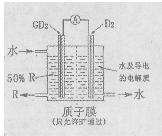
(4)某科研单位依据电化学原理用GD2来制备一种强酸R,装置如右图,电极为含有某种催化剂的多孔材料,能吸附气体,同时也能使气体与电解质溶液充分接触。通入GD2的电极为?极,其电极反应式为?;
(5)甲、乙、丙分别是B、F、G三种元素最高价含氧酸的钠盐,甲、乙都能与丙发生反应,且丙用量不同,反应产物不同。回答问题:
①向甲溶液中缓慢滴加过量的丙溶液,可观察到的实验现象是?;
②向乙溶液中缓慢滴加过量的丙溶液发生反应的离子方程式为?、?。
参考答案:

本题解析:略
本题难度:一般
5、填空题 (4分)氮可以形成多种离子,如N3-、NH、N、NH、N2H、N2H等,已知N2H与N2H是由中性分子结合质子形成的,类似于NH,因此有类似于NH的性质。
(1) NH的电子式为____________。(2)N有______个电子。
(3)写出两种由多个原子组成的含有与N电子数相同的物质的化学式__________。
(4)等电子数的粒子往往具有相似的结构,试预测N的空间构型________________。
参考答案:(1)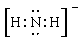 ? (2)22? (3)CO2、N2O (4)直线形
? (2)22? (3)CO2、N2O (4)直线形
本题解析:(1)NH是10电子的阴离子,其电子式为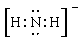 。
。
(2)由于是阴离子,所以N中含有的电子数是7×3+1=22。
(3)根据电子是22个可知,化合物的化学式可以是CO2、N2O等。
(4)CO2是直线型结构,所以根据等电子数的粒子往往具有相似的结构可知,N的空间构型是直线型。
本题难度:一般