1、选择题 通过化学反应不能实现的是(?)
A.生成一种新离子
B.生成一种新分子
C.生成一种新原子
D.生成一种新单质
参考答案:C
本题解析:原子是化学变化中的最小微粒,所以通过化学反应不可能生成一种新原子,选项C是错误的,其余都是正确的,答案选C。
本题难度:简单
2、选择题 Q、W、X、Y、Z都是短周期元素。X、Y、Q在周期表中的位置关系如图。W、Z的最外层电子数相同,Z的核电荷数是W的2倍。则下列说法不正确的是
?
A.非金属性:W > Z
B.原子半径:X >Y > Z
C.最高价氧化物对应水化物的碱性:X > Y
D.氢化物稳定性:Q > W
参考答案:D
本题解析:根据核外电子排布原理,设W、Z的电子数分别为2+x、2+8+x,则(2+x)×2=2+8+x,解得:x=6,说明W、Z分别是氧、硫,同主族元素的非金属性随核电荷数增大而减弱,则氧的非金属性比硫强,故A正确;读图可知元素在周期表中的位置,则X、Y、Q分别是钠、铝、碳,同周期主族元素的原子半径随核电荷数增大而减小,则原子半径:Na>Al>S,故B正确;同周期主族元素的金属性随核电荷数增大而减弱,则钠的金属性比铝强,由于金属性越强,最高价氧化物对应水化物的碱性越强,则碱性:NaOH>Al(OH)3,故C正确;同周期主族元素的非金属性随核电荷数增大而增强,则碳的非金属性比氧弱,由于非金属性越强,气态氢化物越稳定,则稳定性:CH4<H2O,故D错误。
本题难度:简单
3、填空题 短周期主族元素A、B、C、D原子序数依次增大,且只有C为金属元素。A、C位于同一主族,B是地壳中含量最多的元素,B、C的最外层电子数之和与D的最外层电子数相等。请回答下列问题:
(1)D的最高价氧化物的水化物的名称为__________________。
(2)C2B2的电子式为_________________________,其中含有的化学键类型为
_________________。
(3)由上述四种元素中的三种组成某种盐,水溶液显碱性,是家用消毒剂的主要成分。将该盐溶液滴入KI淀粉溶液中,溶液变为蓝色,则反应的离子方程式为:
________________________________________________________________________。
(4)用石墨电极电解CD的饱和溶液,电解反应的离子方程式为:________________________________________,若反应后溶液的体积为200 mL,测得pH为13(常温下测定),则阳极得到的气体质量为_______________,外电路中通过电子的物质的量为___________________。
(5)实验室欲检验CD溶液中所含的D–,操作方法和现象为_____________________________________。
参考答案:(1)高氯酸 (2分)
(2) 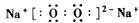 ?(2分)?离子键和共价键(或非极性共价键) (2分)
?(2分)?离子键和共价键(或非极性共价键) (2分)
(3)2I– + ClO– + H2O = I2 + Cl– + OH– (2分)
(4)2Cl– +  2H2O? Cl2↑+ H2↑+ 2OH– (2分)? 0.71 g (2分)? 0.02 mol (2分)
2H2O? Cl2↑+ H2↑+ 2OH– (2分)? 0.71 g (2分)? 0.02 mol (2分)
(5)取适量NaCl溶液置于试管中,向其中滴入少量稀硝酸酸化,再滴入AgNO3溶液,若产生白色沉淀,则证明有Cl– (2分)
本题解析:略
本题难度:一般
4、选择题 l3C?—NMR(核磁共振)、15N—NMR可用于测定蛋白质、核酸等生物大分子的空间结构,下面有关13C、15N叙述正确的是(?)
A.13C与15N有相同的中子数? B.13C与C60互为同素异形体
C. 15N与14N互为同位素?D.15N的核外电子数与中子数相同
参考答案:C
本题解析:A.13C与15N的中子数分别为7、8,故A错误;
B.13C为原子,C60为单质,二者不是同素异形体,故B错误;
C.15N与14N为质子数都是7,但中子数不同的原子,则互为同位素,故C正确;
D.15N的核外电子数为7,中子数为15-7=8,故D错误;
故选C。
点评:本题考查原子的构成及原子中的数量关系,较简单,熟悉同位素、同素异形体的概念及判断可解答。
本题难度:简单
5、选择题 已知短周期元素的离子:aA2+、bB+、cC3-、dD- 都具有相同的电子层结构,则下列叙述正确的是
A.原子半径 A>B>D>C
B.原子序数 d>c>b>a
C.离子半径C>D>B>A
D.单质的还原性 A>B>D>C
参考答案:C
本题解析:aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则一定满足关系式a-2=b-1=c+3=d+1。其中A和B属于金属,位于同一周期,且A在B的右侧。C和D是非金属,位于同一周期,且位于A和B的上一周期,其中D位于C的右侧。同周期自左向右原子半径逐渐减小,金属性逐渐减弱,非金属性逐渐增强。在核外电子排布相同的条件下,微粒半径随原子序数的增大而减小,所以只有选项C是正确的,答案选C。
点评:该题是中等难度的试题,也高考中的常见题型。试题贴近高考,侧重对学生能力的培养。该题以“周期表中元素的推断”为载体,比较全面考查学生有关元素推断知识和灵活运用知识的能力。考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。
本题难度:一般