1、选择题 元素X形成的离子与钙离子的核外电子排布相同,且X的离子半径小于负二价硫离子的半径,X元素为(?)
A.Al
B.P
C.Ar
D.K
参考答案:D
本题解析:具有相同电子层结构的微粒,核电荷数越大其离子半径越小。选项A,Al3+具有第二周期稀有气体电子层结构;选项B,磷离子半径大于负二价硫离子的半径;选项C,Ar为稀有气体元素,不能形成离子;选项D,K+具有与钙离子相同的电子层结构,且半径小于负二价硫离子。
本题难度:一般
2、选择题 短周期元素X、Y、Z、W、Q在周期表中的相对位置如图所示。下列说法不正确的是
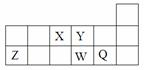
A.离子半径的大小顺序为W>Q>Y>Z
B.X、Y、W三种元素的电负性大小顺序为X>Y>W
C.X、Z、W三种元素的最高价氧化物对应的水化物均能与强碱反应
D.元素X的最简单氢化物与Q的氢化物化合的产物中既含共价键又含离子键
参考答案:B
本题解析:X、Y、Z、W、Q分别为N、O、Al、S、Cl。A、形成简单离子后WQ为3个电子层,YZ为2个电子层,电子层数相同的微粒质子数多,半径大,正确;B、电负性同周期从左到右增大,同主族从下到上增大,错误;C、X、Z、W三种元素的最高价氧化物对应的水化物中XW为酸,Z为两性的氢氧化铝,均与强碱反应,正确;D、该化合产物为NH4Cl,为离子化合物,正确。
本题难度:一般
3、填空题 (12分)下表列出了A~R 9种元素在周期表中的位置:
族
周期
| ⅠA
| ⅡA
| ⅢA
| ⅣA
| ⅤA
| ⅥA
| ⅦA
| 0
|
二
| ?
| ?
| ?
| E
| ?
| F
| ?
| ?
|
三
| A
| C
| D
| ?
| ?
| ?
| G
| R
|
四
| B
| ?
| ?
| ?
| ?
| ?
| H
| ?
|
(1)在这些元素中,化学性质最不活泼的原子的原子结构示意图为?。
(2)地壳中含量最多的非金属元素是?(用元素符号填空)。
(3)这些元素中的最高价氧化物对应的水化物中,酸性最强的是 ?,碱性最强的是?,呈两性的氢氧化物是?(用化学式填空)。
(4)写出D与氢氧化钠溶液反应的化学方程式: ? 。
参考答案:(12分)(1)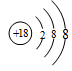 (2)O? (3)HClO4 , KOH?, Al(OH)3
(2)O? (3)HClO4 , KOH?, Al(OH)3
(4)2Al+2NaOH+2H2O=2NaAlO2+3H2↑
本题解析:考查元素周期表的结构及元素周期律的应用。根据元素在周期表中的位置可知,A~R 9种元素分别是Na、K、Mg、Al、C、O、Cl、Br、Ar。稀有气体分子的最外层电子已经达到稳定结构,所以Ar的性质最不活泼。金属性越强最高价氧化物的水化物的碱性越强,同样非金属性越强,最高价氧化物的水化物的酸性越强。所以分别是高氯酸和氢氧化钾。
本题难度:一般
4、选择题 M 2+ 离子有2个电子层,则M在周期表的位置是
A.第二周期零族
B.第二周期Ⅷ族
C.第二周期ⅡA族
D.第三周期ⅡA族
参考答案:D
本题解析:M 2+ 离子有2个电子层,则根据核外电子排布可知,该元素的原子序数是10+2=12。价电子数=最外层电子数=主族序数,电子层数=周期数,所以该元素位于第三周期第ⅡA族,答案选D。
点评:该题是高考中的常见考点,侧重考查学生对元素周期表结构以及元素周期表编制原则的了解掌握情况,意在巩固学生的基础,提高学生分析、归纳和总结问题的能力。
本题难度:简单
5、填空题 元素周期表是学习化学的重要工具,它隐含许多信息和规律。下表是元素周期表的一部分,根据周期表知识回答下列问题。
?
| ?
| ?
|
?
| ?
| ?
| ?
| ?
| ?
| A
| ?
| ?
|
?
| B
| C
| ?
| ?
| D
| E
| ?
|
?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
|
| | | | | | | | | | | | | | | | |
|
(1)C 和D元素名称分别是__________、__________。
(2)比较这五种元素的原子半径从大到小? (填元素符号);
(3)上述五种元素的最高价氧化物对应水化物酸性最强的是?(填化学式);
(4)写出A和C形成的化合物与氢氧化钠溶液反应的离子方程式:
?;
(5)用电子式表示B和E形成化合物的过程:
?。
参考答案:(1)镁、硫?(2)Mg 、Al、S、Cl、O(3)HClO4
(4)Al2O3+2OH-=2AlO2-+2H2O (5)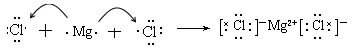
本题解析:根据元素在周期表中的相对位置可知,A是O,B是Mg, C是Al,D是S,E是Cl。
(1)C 和D元素名称分别是镁、硫。
(2)同周期自左向右原子半径逐渐减小,同主族自上而下,原子半径逐渐增大,所以这五种元素的原子半径从大到小Mg 、Al、S、Cl、O。
(3)非金属性越强,最高价氧化物的水化物的酸性越强,又因为同周期自左向右非金属性逐渐增强,同主族自上而下非金属性逐渐减弱,所以五种元素的最高价氧化物对应水化物酸性最强的是HClO4。
(4)A和C形成的化合物是氧化铝,属于两性氧化物,因此与氢氧化钠溶液反应的离子方程式是Al2O3+2OH-=2AlO2-+2H2O。
(5)B和E形成的化合物是氯化镁,属于含有离子键的离子化合物,所以其形成过程可表示为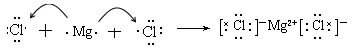 。
。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生基础知识的巩固和训练,有利于提高学生的逻辑推理能力和应试能力。本题主要是元素“位、构、性”三者关系的综合考查,比较全面考查学生有关元素推断知识和灵活运用知识的能力。该题以“周期表中元素的推断”为载体,考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。
本题难度:一般