1、填空题 (本小题15分)A、B、C、D四元素的核电荷数依次增加,它们的离子的电子层数相同且最外层电子数均为8。A原子的L层电子数与K、M层电子数之和相等,D原子的K、L层电子数之和等于电子总数的一半。回答以下问题:
(1)四元素的符号依次是A______;B______;C________;D______。
(2)写出B、D元素的离子结构示意图:
B.______________________; D.______________________。
(3)用电子式表示A、C元素形成的离子化合物的过程:
________________________________________________________。
(4)在A、B、C、D最高价氧化物水化物中:
比较其中酸的酸性强弱:____________________________;
比较其中碱的碱性强弱:____________________________。
参考答案:
(1) S;Cl;K;Ca(4分,每空1分)
(2) Cl-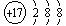 (2分) Ca2+
(2分) Ca2+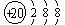 (2分)
(2分)
(3)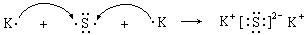 (3分)
(3分)
(4)酸性:HClO4>H2SO4 (2分)?碱性:KOH>Ca(OH)2(2分)
本题解析:因A原子的L层电子数与K、M层电子数之和相等,所以A的核电荷数为2×8=16,A为硫元素。D原子的K、L层电子数之和等于电子总数的一半,所以D原子的核电荷数是(2+8)×2=20,D为钙元素。根据核电荷数依次增大,并都形成离子,排除氩原子和磷元素,B为氯元素,C为钾元素。A、B、C、D最高价氧化物水化物分别为H2SO4、HClO4、应试策略:掌握同周期元素、同主族元素的性质递变规律是解题的关键。
1.同周期元素(从左→右)
①电子层数相同,最外层电子由1→8。
②原子半径逐渐减小。
③失电子能力渐弱、得电子能力渐强,即金属性减弱、非金属性增强。金属单质的还原性减弱,例如:Na>Mg>Al与水反应的能力逐渐减弱。非金属单质的氧化性增强,还原性减弱。例如氧化性:Si<P<S<Cl2,还原性:Si>P>S>Cl2。
④最高价氧化物的水化物:碱性减弱、酸性增加。例如:
NaOH、Mg(OH)2、Al(OH)3、H4SiO4、H3PO4、H2SO4、HClO
强碱?中强碱?两性?弱酸?中强酸?强酸?最强酸
⑤气态氢化物的稳定性渐强、还原性渐弱。
例如:稳定性:SiH4<PH3<H2S<HCl;还原性:SiH4>PH3>H2S>HCl。
2.同主族元素(从上→下)
①最外层电子数相同→化学性质相似。
②电子层数递增,半径递增→化学性质递变。
③非金属性渐弱、金属性渐强。
④最高价氧化物的水化物的酸性减弱、碱性增强。例如:
eq o(sup 2(H2CO3、H4SiO4、H4——————————————————————————————
⑤气态氢化物的稳定性减弱、还原性增强。例如:
eq o(sup 2(HF、? HCl、? HB———————————————————————→
KOH、Ca(OH)2。
本题难度:一般
2、选择题 下列基态原子的电子构型中,正确的是
A.3d94s2
B.3d44s2
C.3d104s0
D.3d84s2
参考答案:D
本题解析:略
本题难度:简单
3、选择题 向碘化钾溶液中加入适量氯水后有单质碘生成.要将单质碘从水中分离出来,下列方法中最好的是
A.在过滤器中过滤
B.在蒸馏烧瓶中蒸馏
C.在蒸发皿中蒸发结晶
D.在分液漏斗中萃取分液
参考答案:D
本题解析:向碘化钾溶液中加入适量的氯水后,形成了以KCl和I2两种物质为溶质的水溶液.这两种溶质均易溶于水,但在苯、四氯化碳等有机溶剂中,I2易溶,KCl不溶.
本题难度:一般
4、填空题 (15分)
A、B、D、E、F为短周期元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍。B 在D中充分燃烧能生成其最高价化合物BD2。E+与D2-具有相同的电子数。A在F中燃烧,产物溶于水得到一种强酸。回答下列问题:
(1)A在周期表中的位置是?,写出一种工业制备单质F的离子方程式?。
(2)B、D、E组成的一种盐中,E的质量分数为43%,其俗名为?,其水溶液与F单质反应的化学方程式为?;在产物中加入少量KI,反应后加人CC14并振荡,有 机层显?色。
(3)由这些元素组成的物质,其组成和结构信息如下表:
物质
| 组成和结构信息
|
a
| 含有A的二元离子化合物
|
b
| 含有非极性共价键的二元离子化合物,且原子数之比为1:1
|
c
| 化学组成为BDF2
|
d
| 只存在一种类型作用力且可导电的单质晶体
|
a的化学式为?;b的化学式为?;;c的电子式为?;
d的晶体类型是?。
(4)由A和B、D元素组成的两种二元化合物形成一类新能源物质。一种化合物分子通过?键构成具有空腔的固体;另一种化合物(沼气的主要成分)分子进入该空腔,其分子的空间结构为?。
参考答案:
⑴第一周期IA族?2Cl- +2H2O 2OH- +H2↑+C12↑(或2NaCl(熔融)
2OH- +H2↑+C12↑(或2NaCl(熔融)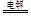 2Na+Cl2。↑(每空2分)
2Na+Cl2。↑(每空2分)
⑵纯碱(或苏打)(1分) 2Na2CO3+Cl2+H2O = NaClO+NaCl+2NaHCO3? ( 2分)紫(1分)
⑶NaH (1分) Na2〇2和Na2C2 ( 2分)?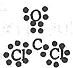 ?(1分)?金属晶体(1分)
?(1分)?金属晶体(1分)
⑷氢(1分)正四面体(1分)
本题解析:根据“非金属元素A最外层电子数与其周期数相同”确定A为氢元素,然后根据其它信息推出B为碳元素,D为氧元素,E为钠元素,F为氯元素。
⑴H在周期表中的位置为第一周期IA族;工业制备上Cl2的原理有电解饱和食盐水或电解熔融的NaCl,据此便可写出其相应的离子方程式。
⑵C、O、Na组成的一种盐中,满足E的质量分数为43%的盐为Na2CO3,俗称纯碱或苏打;其水溶液与Cl2反应,可理解为Cl2先与水反应有HCl和HClO,Na2CO3水解有NaHCO3和NaOH,二者再反应,可确定其生成物有NaClO、NaCl 、NaHCO3,然后通过氧化还原反应的配平方法将其配平;在产物中加入少量KI,NaClO将KI氧化生成I2,反应后加人CC14并振荡溶液显紫色。
⑶在这些元素中只有Na才与H形成二元离子化合物NaH(a的化学式 );形成含有非极性共价键的二元离子化合物,且原子数之比为1:1的物质有Na2〇2和Na2C2(b的化学式);BDF2的化学式为COCl2,其结构式为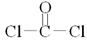 ,据此便可写出其电子式
,据此便可写出其电子式 ;只存在一种类型作用力且可导电的单质晶体为金属钠,属于金属晶体。
;只存在一种类型作用力且可导电的单质晶体为金属钠,属于金属晶体。
⑷由H和C、O元素组成的两种二元化合物CH4、H2O能形成一类新能源物质,一种化合物分子(H2O)通过氢键构成具有空腔的固体;另一种化合物(沼气的主要成分CH4)分子进入该空腔,CH4分子的空间结构为正四面体结构。
本题难度:一般
5、填空题 )已知甲、乙、丙、丁、戊、己为短周期元素形成的六种粒子,它们的电子总数都为18,请回答下列问题:
(1)甲为双核单质分子,可与水发生置换反应,甲的电子式为?。
(2)乙为两种元素形成的双核离子,含该离子的水溶液中加入适量氯水出现浑浊,该反应的离子方程式为?。
(3)丙为含两种元素的分子,且原子个数比为1∶1,实验室中可以用丙制备氧气,反应的化学方程式为?。
(4)戊属于烃,已知1 g戊在氧气中完全燃烧放出52 kJ的热量,戊燃烧的热化学方程式为?。
(5)己为两种元素组成的六原子分子,常用作火箭的燃料,则己的化学式为? ______________?,分子中含有的化学键为?(填“离子键”或“共价键”)。己与丙反应可生成对环境没有影响的两种物质,一种是大气的主要成分,另一种在常温下是无色液体,该反应的化学方程式为?。
参考答案:(1)
(2)Cl2+HS-=S↓+2Cl-+H+
(3)2H2O2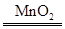 2H2O+O2↑
2H2O+O2↑
(4)C2H6(g)+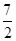 O2(g)=2CO2(g)+3H2O(l)? ΔH="-1" 560 kJ/mol或2C2H6(g)+7O2(g)=4CO2(g)+6H2O(l)? ΔH="-3" 120 kJ·mol-1
O2(g)=2CO2(g)+3H2O(l)? ΔH="-1" 560 kJ/mol或2C2H6(g)+7O2(g)=4CO2(g)+6H2O(l)? ΔH="-3" 120 kJ·mol-1
(5)N2H4?共价键? N2H4+2H2O2=N2+4H2O
本题解析:(1)含有18电子的双核单质分子只有F2,F2可与水发生反应生成HF和O2,F2的电子式为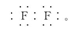
(2)18电子的双核离子只有HS-,HS-与Cl2反应为HS-+Cl2=H++2Cl-+S↓,有S沉淀生成,溶液变浑浊。
(3)含有两种元素的分子,原子个数比为1∶1的分子为H2O2,H2O2制取氧气的化学方程式为2H2O2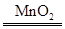 2H2O+O2↑。
2H2O+O2↑。
(4)含有18电子的烃为C2H6,1 g乙烷完全燃烧放出52 kJ热量,乙烷完全燃烧的化学方程式为2C2H6+7O2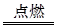 4CO2+6H2O,乙烷完全燃烧的热化学方程式为2C2H6(g)+7O2(g)=4CO2(g)+6H2O(l)? ΔH="-3" 120 kJ·mol-1。
4CO2+6H2O,乙烷完全燃烧的热化学方程式为2C2H6(g)+7O2(g)=4CO2(g)+6H2O(l)? ΔH="-3" 120 kJ·mol-1。
(5)常用作火箭推进剂的六原子分子为N2H4,分子中含有的化学键为共价键。N2H4与H2O2反应生成N2与H2O,反应的化学方程式为N2H4+2H2O2=N2+4H2O
本题难度:一般