1、填空题 (8分)有A、B、C、D、E 5种元素,它们的核电荷数依次增大,且都小于20。其中C、E是金属元素;A和E属同一族,它们原子的最外层电子排布为ns1。B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,C原子最外层上电子数等于D原子最外层上电子数的一半。请回答下列问题:
(1)由这五种元素组成的一种化合物是(写化学式)__________________。
(2)写出C元素基态原子的电子排布式______________________________ 。
(3)用电子排布式表达式表示B元素原子的价电子构型_______________。
(4)元素B与D的电负性的大小关系是___________,C与E的第一电离能的大小关系是________________。(用元素符号和“﹥或﹤或﹦”表示)
(5)DB2是由?键构成的?(填“极性”或“非极性” )分子;
分子空间构型是?。
参考答案:(1)KAl(SO4)2?12H2O(1分)?(2)1s22s22p63s23p1 (1分)?(3)2s22p4 ?(1分)
(4)O>S? Al>K (2分)?(5)极性;极性; V型(3分)
本题解析:根据元素的结构及有关性质可知,A、B、C、D、E 5种元素分别是H、O、Al、S、K。
(1)由这五种元素组成的一种化合物应该是明矾,化学式为KAl(SO4)2?12H2O。
(2)根据构造原理可知,Al元素基态原子的电子排布式为1s22s22p63s23p1 。
(3)根据构造原理可知,氧元素原子的价电子构型是2s22p4。
(4)非金属性越强,电负性越大,氧元素的非金属性其余硫元素的,所以氧元素的电负性大于硫元素的。金属性越强,第一电离能越小,铝的金属性弱于K的,所以第一电离能是Al>K。
(5)根据价层电子对互斥理论可知,SO2中S原子的孤对电子对数是(6-2×2)÷2=1,所以SO2是含有极性键的极性分子,空间构形是V型。
本题难度:一般
2、填空题 (12分)短周期主族元素A、B、C、D的原子序数依次增大,其中A、C同主族,B、C、D同周期,A原子的最外层的电子数是次外层电子数的3倍,B是短周期元素中原子半径最大的主族元素。试回答下列问题:
(1)、A的元素符号:?;D的原子结构示意图:?;C原子的核外电子排布式:?;B2A2的电子式:?;
A的价电子排布图:?。
(2)、A、B、C三种元素形成的简单离子的半径由大到小的顺序是(用离子符号表示):?
?。
(3)、CA2与D元素的单质在水溶液中反应得化学方程式是:?。
参考答案:(1)?o?氯原子结构示意图? (+17)? 2? 8? 7
C原子的核外电子排布式:1s22s22p63s23p4
过氧化钠的电子式?氧的价电子排布图?
(2)? S2->O2->Na+?
(3)Cl2? +? SO2? +H2O? =? 2HCl? +H2SO4
本题解析:A原子的最外层的电子数是次外层电子数的3倍为氧,B、C、D同周期第三周期,而且B是短周期元素中原子半径最大的主族元素,B:Na? C:S? D:Cl
本 题难度:一般
3、选择题 某课外兴趣小组通过实验发现钾和钠的性质相似,下列说法中能最好地解释这个事实的是(? )
A.都是金属元素
B.原子半径相差不大
C.最外层电子数相同
D.最高化合价相同
参考答案:C
本题解析:决定元素化学性质的主要因素是最外层电子数。钠和钾都属于第IA,最外层电子数相同,所以性质相似,答案选C。
本题难度:一般
4、选择题 X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示,若Y原子的最外层电子数是内层电子数的3倍,下列说法正确的是
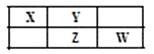
A.四种元素中,原子半径最大的是W
B.X元素的最高价氧化物对应的水化物酸性最强
C.单质的氧化性:W > Z
D.气态氢化物的熔点和沸点:Z>W
参考答案:D
本题解析:此题容易做错。关键是概念要清楚。选项A中7.68g CuSO4的物质的量是0.048 mol,加入500 mL水不能得到0.1 mol/L 的硫酸铜溶液。选项B中12.0g胆矾物质的量为0.048mol,含硫酸铜物质的量为0.048 mol,配成500mL溶液,浓度也不是0.1 mol/L。选项C中硫酸铜物质的量为0.05 mol,但是溶液的体积不是500 mL,因此也不正确。只有选项D是正确。此题也可以这样思考:溶液的体积是500 mL,所需的水并不是500mL,配制0.1mol/L硫酸铜溶液500mL,若用无水硫酸铜,其质量为0.1×0.5×160=8.0g;若用胆矾,其质量为0.1×0.5×250=12.5g。称量相应的固体后,通过溶解、转移、洗涤、定容等步骤,配成500mL溶液,再取用480mL即可。
本题难度:一般
5、选择题 短周期元素X、Y、Z在周期表中所处的位置如图所示,三种元素的原子质子数之和为32,下列说法正确的是
?
A.三种元素中,Z元素的最高价氧化物对应的水化物的酸性最强
B.X、Z两种元素的气态氢化物相互反应的产物是共价化合物
C.三种元素对应的气态氢化物中,Z元素形成的氢化物最稳定
D.Y元素的气态氢化物与Y的最高价氧化物对应的水化物不可能发生反应
参考答案:C
本题解析: 根据图像必为第二、三周期元素,则设X、Y、Z的序数分别为x、x+9、x+2,解得x=7,则,X、Y、Z分别为N、S、F。A、氟没有氧化物,错误;B、NH4F含有离子键,为离子化合物,错误;C、Z的非金属性最强,所以气态氰化物最稳定,正确。D、H2S具有较强的还原性与浓H2SO4可以发生氧化还原反应,错误。
本题难度:一般