1、填空题 1 mol单质A与足量盐酸反应,生成22.4L气体(标准状况下),并且元素A转化成与氖的电子层结构相同的离子,据以上事实,回答问题。
(1)元素A的原子结构示意图?。
(2)元素A的最高价氧化物的水化物与盐酸反应的离子方程式?。
(3)举出二个实验事实比较Na与元素A的金属性强弱?、
?。
参考答案:
(1)?(2)Mg(OH)2+H2=Mg2++H2O
(3)Na、Mg分别与H2O反应(其它答案合理也可,下同
本题解析:略
本题难度:简单
2、选择题 某非金属X的最低负价为-m。它的最高价氧化物对应的水化物中有b个氧原子,则这种酸的分子式为( )
A.H2b-8+mXOb
B.H2b-m+8XOb
C.H2b-8-mXOb
D.H2b+8+mXOb
参考答案:A
本题解析:某非金属X的最低负价为-m,最高正价为8- m,H2b-8+mXOb
本题难度:简单
3、选择题 下列物质是化合物的是
A.氯化钠溶液
B.氧气
C.干冰
D.黑火药
参考答案:C
本题解析:
本题难度:一般
4、选择题 已知x、Y是元素周期表中前20号元素,二者原子序数相差3,x、Y能形成化台物M,下列说法正确的是
A.若X和Y处于同一周期,则X的原子半径肯定小于Y的原子半径
B.若X和Y处于不同的周期,则M溶于水所得溶液肯定呈碱性
C.若M属于离子化合物,则该化合物中只存在离子键
D.若M属于离子化台物,则该化合物中原子个数比可能为1:2
参考答案:D
本题解析:A、若X和Y处于同一周期,未指明X、Y的原子序数的大小关系,所以原子半径的大小无法判断,错误;B、若X和Y处于不同的周期,则M溶于水所得溶液有可能显中性,如氯化钙,错误;C、M是离子化合物如过氧化钠,该化合物中存在离子键、共价键,错误;D、M属于离子化台物,如CaCl2,原子个数比可能为1:2,正确,答案选D。
本题难度:简单
5、选择题 下列叙述与对应图式正确的是
A.由下列短周期元素性质的数据推断元素③最高价氧化物对应的水化物碱性最强

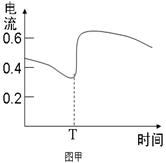
B.图甲表示Zn-Cu原电池反应过程中的电流强度的变化,T时可能加入了H2O2
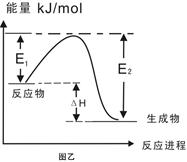
C.图乙表示某一放热反应,若使用催化剂E1、E2、ΔH都会发生改变
D.表示H2燃烧热的热化学方程式为:2H2(g)+O2(g)=2H2O(l);△H= -571.6kJ/mol
参考答案:B
本题解析:A、根据同主族自上而下,原子半径逐渐增大可知,③是Li,⑥是Na,所以⑥最高价氧化物对应的水化物碱性最强,A不正确;B、双氧水具有强氧化性,能加快反应速率,所以电流强度增大,B正确;C、催化剂只能改变活化能,但不能改变反应热,C不正确;D、燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,所以表示H2燃烧热的热化学方程式为H2(g)+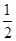 O2(g)=H2O(l)?△H=-285.8kJ/mol,D不正确,答案选B。
O2(g)=H2O(l)?△H=-285.8kJ/mol,D不正确,答案选B。
本题难度:一般