| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点归纳《离子共存》在线测试(2019年最新版)(四)
参考答案:C 本题解析:离子间如果发生化学反应,则不能大量共存,反之是可以的。A中能生成硫酸钡白色沉淀;B中OH-和Fe3+以及HCO3-都不能大量共存;D中H+和ClO-不能大量共存,所以正确的答案选C。 本题难度:一般 2、选择题 25℃时,下列各组离子在指定溶液中一定能大量共存的是 |
参考答案:A
本题解析:A.0.1mol·L-1 AlC13溶液中:H+、Na+、Cl-、SO42-之间不反应,可以大量共存,A正确;B.含有0.1mol·L-1 Fe3+的溶液中SCN-不能大量共存,B错误;C.使甲基橙变红色的溶液显酸性,则Fe2+、NO3-之间发生氧化还原反应,不能大量共存,C错误;D.由水电离产生的c(H+)=10-12 mol·L-1的溶液中水的电离被抑制,因此溶液可能显酸性,也可能显碱性,显酸性HCO3-不能大量共存。显碱性NH4+、HCO3-均不能大量共存,D错误,答案选A。
考点:考查离子共存的正误判断
本题难度:困难
3、选择题 下列关系式中正确的是
A.等体积等物质的量浓度的NaClO(aq)与NaCl(aq)中离子总数大小:N前>N后
B.0.1 mol·L-1Na2S溶液中:2c(Na+) c(S2-)+c(HS-)+c(H2S)
c(S2-)+c(HS-)+c(H2S)
C.常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:
c(Na+)>c(Cl—)>c(CH3COOH)
D.0.1 mol·L-1Na2CO3溶液与0.1 mol·L-1NaHCO3溶液等体积混合
c(CO32-)+2c(OH-) c(HCO3-?)+3c(H2CO3)+2c(H+)
c(HCO3-?)+3c(H2CO3)+2c(H+)
参考答案:D
本题解析:
选项A中NaClO(aq)与NaCl(aq)中电荷守恒式分别为c(Na+)+c(H+) c(ClO-)+c(OH-)、c(Na+)+c(H+)
c(ClO-)+c(OH-)、c(Na+)+c(H+) c(Cl-)+c(OH-),由于NaClO水解显碱性,因此有c(H+)NaClO<c(H+)NaCl,所以NNaClO<NNaCl,A错。选项B中的物料守恒式应为
c(Cl-)+c(OH-),由于NaClO水解显碱性,因此有c(H+)NaClO<c(H+)NaCl,所以NNaClO<NNaCl,A错。选项B中的物料守恒式应为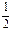 c(Na+)
c(Na+) c(S2-)+c(HS-)+c(H2S)。选项C可以这样分析:先写出混合溶液的电荷守恒式:c(H+)+c(Na+)
c(S2-)+c(HS-)+c(H2S)。选项C可以这样分析:先写出混合溶液的电荷守恒式:c(H+)+c(Na+) c(OH-)+ c(Cl—)+ c(CH3COO-),又由于溶液呈中性即c(H+)=c(OH-),因此混合溶液中应有c(Na+)
c(OH-)+ c(Cl—)+ c(CH3COO-),又由于溶液呈中性即c(H+)=c(OH-),因此混合溶液中应有c(Na+) c(Cl—)+c(CH3COO-),根据物料守恒可得c(Na+)
c(Cl—)+c(CH3COO-),根据物料守恒可得c(Na+) c(CH3COOH)+c(CH3COO-),所以有c(Na+)>c(Cl—)
c(CH3COOH)+c(CH3COO-),所以有c(Na+)>c(Cl—) c(CH3COOH),C错。
c(CH3COOH),C错。
本题难度:一般
4、选择题 下列关于电解质溶液的正确判断是( )
A.在pH=14的溶液中,K+、Cl-、HCO3-、Na+可以大量共存
B.在pH=0的溶液中,Na+、NO3-、SO32-、K+可以大量共存
C.由0.1mol?L-1一元碱BOH溶液的pH=10,可推知BOH溶液存在BOH=B++OH-
D.由0.1mol?L-1一元酸HA溶液的pH=3,可推知NaA溶液存在A-+H2O?HA+OH-
参考答案:A.pH=14的溶液呈碱性,与OH-反应的HCO3-不能大量共存,故A错误;
B.pH=0的溶液呈酸性,与H+反应的SO32-不能大量共存,故B错误;
C.0.1mol?L-1一元碱BOH溶液的pH=10,说明BOH不能完全电离,BOH溶液存在BOH?B++OH-,故C错误;
D.0.1mol?L-1一元酸HA溶液的pH=3,说明HA不能完全电离,则NaA溶液存在A-+H2O?HA+OH-,故D正确.
故选D.
本题解析:
本题难度:一般
5、选择题 水溶液中能大量共存的一组离子是(?)
A.Na+、Ca2+、Cl-、SO42-
B.Fe2+、H+、SO32-、ClO-
C.Mg2+、NH4+、Cl-、SO42-
D.K+、Fe3+、NO3-、SCN-
参考答案:C
本题解析:A. Ca2+、SO42-会形成微溶物,不能大量共存,错误;B.Fe2+、H+、ClO-会发生氧化还原反应而不能大量共存,错误;C.Mg2+、NH4+、Cl-、SO42-不会发生任何反应,可以大量共存,正确;D. Fe3+、SCN-会发生络合反应不能大量共存,错误。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点大全《化学实验的.. | |