1、选择题 已知:①硫酸比次氯酸稳定②硫酸的酸性弱于高氯酸③H2S 比HCl易被氧化④HCl比 H2S更容易由单质合成⑤盐酸的酸性比氢硫酸(H2S)强。⑥硫不溶于水,而氯气溶于水⑦通常状态下硫为淡黄色晶体,而氯气为黄绿色气体⑧在与金属形成的化合物中硫为-2价,而氯为-1价⑨在跟同一金属(如Cu或Fe)反应时,金属被硫氧化成低价态,被氯氧化成高价态。上述事实能说明硫的非金属性比氯弱的是
A.②③④⑨
B.③④⑤⑦⑧⑨
C.②③④⑧⑨
D.①③⑤⑧
参考答案:A
本题解析:略
本题难度:一般
2、选择题 下列各组物质的性质比较中,正确的是
A.热稳定性:H2O>HF>H2S
B.沸点:HF>HCl>HBr
C.密度:CH3CH2CH2Cl>CH3CH2Cl>CH3Cl
D.氧化性:Fe3+>Cu2+>H+
参考答案:D
本题解析:A项中氢化物的稳定性与元素的非金属性相关,非金属性越强气态氢化物越稳定,故错误,正确的为HF>H2O>H2S;B正确的顺序为HF>HBr>HCl;C中没有说明外界情况,无法判断,错误;D正确;
本题难度:一般
3、填空题 已知有五种元素的原子序数的大小顺序为C>A>B>D>E,A、C同周期,B、C同主族;A与B形成的离子化合物A2B中所有的离子的电子数都相同,其电子总数为30;D和E可形成4核10电子分子。试回答下列问题:
1. 写出下列元素的名称:A?,B?
2. 写出D元素的原子结构示意图?,C元素在周期表中的位置?。
3. 写出下列物质的电子式
E与B形成的化合物:?
A、B、E形成的化合物:?
D、E形成的化合物:?
4. 写出C的最高价氧化物对应水化物的浓溶液与铜反应的化学方程式?
写出D的最高价氧化物对应水化物的稀溶液与铜反应的离子方程式?
参考答案:(本题共11分,前3小题每个问题各1分,第4小题各个方程式2分)
1、A?钠?,B?氧? 2、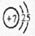 ?,第三周期ⅥA族
?,第三周期ⅥA族
3、 (?或
(?或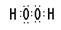 )?、?
)?、?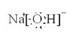 ?、?
?、? ?
?
4、 、
、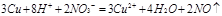
(不注明浓、不写明条件、不配平均不给分)
本题解析:(1)A与B形成的离子化合物A2B中所有的离子的电子数都相同,其电子总数为30,所以A是Na,B是O。又因为原子序数的大小顺序为C>A>B>D>E,A、C同周期,B、C同主族,所以C是S。D和E可形成4核10电子分子,因此D是N,E是H。
(2)氮元素的原子序数是7,其原子结构示意图为 ;S的原子序数是16,位于第三周期ⅥA族。
;S的原子序数是16,位于第三周期ⅥA族。
(3)H和O可以形成水和双氧水,都是共价化合物,其电子式分别是 、
、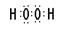 ;A、B、E形成的化合物是氢氧化钠,含有离子键和极性键,电子式是
;A、B、E形成的化合物是氢氧化钠,含有离子键和极性键,电子式是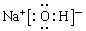 ;D、E形成的化合物是氨气,含有极性键,电子式是
;D、E形成的化合物是氨气,含有极性键,电子式是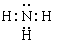 。
。
(4)C的最高价氧化物对应水化物是硫酸,浓硫酸具有氧化性,和铜反应的方程式是2H2SO4(浓)+Cu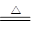 CuSO4+2H2O+SO2↑;D的最高价氧化物对应水化物是硝酸,硝酸也具有氧化性,和铜反应的离子方程式是3Cu+8H++2NO3-=3Cu2++4H2O+2NO↑。
CuSO4+2H2O+SO2↑;D的最高价氧化物对应水化物是硝酸,硝酸也具有氧化性,和铜反应的离子方程式是3Cu+8H++2NO3-=3Cu2++4H2O+2NO↑。
点评:本题属于位、构、性的综合考查,需要熟练掌握元素周期表的结构,然后结合已知的条件逐一推断即可。
本题难度:一般
4、选择题 欲用96%的工业酒精制取无水乙醇时,可选用的方法是
A.加入无水CuSO4,再过滤
B.加入生石灰,再蒸馏
C.加入浓硫酸,再加热,蒸出乙醇
D.将96%的乙醇溶液直接加热蒸馏出苯
参考答案:B
本题解析:试题分析:根据工业制备无水酒精的方法,制备无水酒精时,在95.57%酒精中加入生石灰(CaO)加热回流,使酒精中的水跟氧化钙反应,生成不挥发的氢氧化钙来除去水分,然后再蒸馏得到,故选B。
考点:乙醇的性质
点评:本题主要考查了无水酒精的制备,考虑到乙醇易被浓硫酸氧化,以及常用的干燥剂可以解答。
本题难度:困难
5、选择题 下列说法正确的是
A.元素周期表有7个主族,7个副族,1个零族,1个Ⅷ族,共16纵行
B.X2+的核外电子数目为18,则X在第四周期第ⅡA族
C.Li是最活泼金属,F是最活泼非金属
D.NaOH碱性比KOH强
参考答案:B
本题解析:
元素周期表有7个主族,7个副族,1个零族,1个Ⅷ族,但第Ⅷ族有三个纵行,所以元素周期表共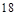 纵行,A错;
纵行,A错;
X2+的核外电子数目为18,则其原子序数为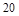 ,是
,是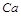 元素,在第四周期第ⅡA族,故B正确;
元素,在第四周期第ⅡA族,故B正确;
F元素的最外层有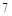 外电子,原子核对电子的引力很大,极易得到
外电子,原子核对电子的引力很大,极易得到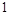 个电子达到最外层
个电子达到最外层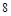 个电子的稳定结构,是最活泼非金属.碱金属随着核电核数的增加,原子半径逐渐增大,还原性增强,金属活性越来越强,所以Li不是最活泼金属,;故C错
个电子的稳定结构,是最活泼非金属.碱金属随着核电核数的增加,原子半径逐渐增大,还原性增强,金属活性越来越强,所以Li不是最活泼金属,;故C错
碱金属随着核电核数的增加,原子半径逐渐增大,还原性增强,金属活性越来越强,所以碱性逐渐增强,故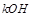 碱性比
碱性比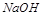 强,故D错
强,故D错
故正确答案为B
本题难度:一般