1、选择题 工业上用洗净的废铜作原料来制备硝酸铜。为了节约原料和防止污染环境,宜采取的方法是
[? ]
A.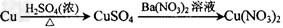
B.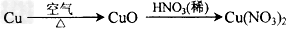
C.
D.
参考答案:B
本题解析:
本题难度:简单
2、实验题 碘化钠是实验室中常用的分析试剂,也常用于医疗和照相业。工业上用铁屑还原法制备NaI,其主要流程如下图,请回答下列问题:
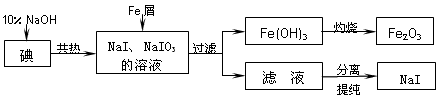
(1)判断碘是否已完全反应的实验方法是______________;
(2)将滤液在低温下分离出NaI样品的过程中,要防止NaI被氧化,最好采取的措施是_____________;
(3)测定产品中NaI含量的方法是:a.称取3.000 g样品、溶解,在250 mL容量瓶中定容; b.量取25.00 mL待测溶液于锥形瓶中;c.用0.1000 mol/LAgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为19.00 mL。
① 上述测定过程所需仪器中,需要检查是否漏液的仪器有__________________。
② 上述样品中NaI的质量分数为_______________ 。
③ 若用上述方法测定产品中NaI的质量分数偏低(测定过程中产生的误差忽略不计),其可能原因有_____________________________
参考答案:(1)取少量反应后的混合液于试管中,滴入几滴淀粉溶液,若溶液未变蓝,则证明碘已完全反应;反之,则未完全反应
(2)隔绝空气分离(或其他合理答案)
(3)①250 mL容量瓶、酸式滴定管;② 95.00%;③样品在空气中被氧化(或样品在空气中吸水)
本题解析:
本题难度:一般
3、填空题 β-锂辉石的主要成分是Li2O·Al2O3·4SiO2,还含 有FeO、CaO、MgO等。以β-锂辉石为原料制备碳酸锂的一种流程如下:?
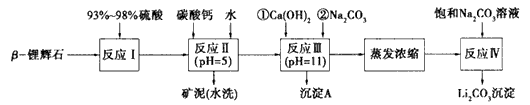
已知:
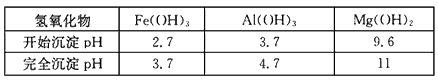
①部分金属氢氧化物开始沉淀和完全沉淀的pH:
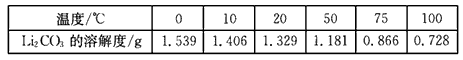
②Li2CO3在不同温度的溶解度如下表:
回答下列问题:
(1)反应Ⅱ中加碳酸钙的作用是____。
(2)写出反应Ⅲ中生成沉淀A的离子方程式___、____。
(3)写出反应Ⅳ的化学方程式___。洗涤所得Li2CO3沉淀要用热水而非冷水,原因是____。
参考答案:(1)除去反应I中过量的H2SO4,控制pH使Fe3+ 、 Al3+完全沉淀
(2)Mg2+ +2OH-=Mg(OH)2↓? ;Ca2++CO32- = CaCO3↓
(3) Li2SO4+Na2CO3=Li2CO3↓+Na2SO4? ;Li2CO3在较高温度下溶解度小,用热水洗涤可减少Li2CO3的损耗
本题解析:
本题难度:一般
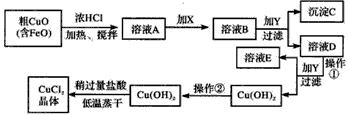
4、填空题 工业上制取CuCl2的生产流程如图
请结合下表数据,回答问题:

(1)溶液A中加入X是一种“绿色”氧化剂,则X是____(填化学式),其目的是___。
(2)在溶液B中加入试剂Y常见的有:CuO、Cu(OH)2、CuCO3、____等,其作用是___。
(3)操作①应控制的pH范围是___;操作②的目的是____。
(4)往Cu(OH)2加入盐酸使Cu(OH)2转变为CuCl2。采用“稍多量盐酸”和“低温蒸干”的目的是____。
参考答案:(1)H2O2 ;将Fe2+氧化为Fe3+
(2)Cu2(OH)2CO3; 调节溶液的pH为3~4(或大于4小于6.4),使Fe3+完全转变为Fe(OH)3 沉淀而除去
Fe3+
(3)大于或等于6.4 ;洗涤Cu(OH)2表面的可溶性杂质
(4)抑制Cu2+的水解,防止 CuCl2晶体中含有Cu(OH)2杂质
本题解析:
本题难度:一般
5、填空题 以氯化钾和钛白厂的副产品硫酸亚铁为原料生产硫酸钾、过二硫酸铵和氧化铁红颜料,原料的综合利用率较高。其主要流程如下:
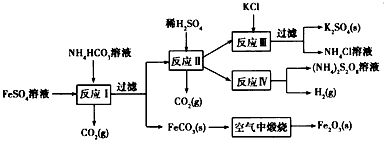
(1)反应I前需在FeSO4溶液中加入____(填字母),以除去溶液中的Fe3+。
A.锌粉 B.铁屑 c.KI溶液 D.H2
(2)反应I需控制反应温度低于35℃,其目的是_________________
(3)工业生产上常在反应Ⅲ的过程中加入一定量的醇类溶剂,其目的是___________________。。
(4)反应Ⅳ常被用于电解生产(NH4)2 S2O8(过二硫酸铵)。电解时均用惰性电极,阳极发生的电极反应可表示为____________________________________________ 。
参考答案:(1)B
(2)防止NH4HCO3分解(或减少Fe2+的水解)
(3)降低K2SO4的溶解度,有利于K2SO4析出
(4)2SO4 2--2e-=S2O82-
本题解析:
本题难度:一般