1、简答题 镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成.由于电池使用后电极材料对环境有危害.某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下:
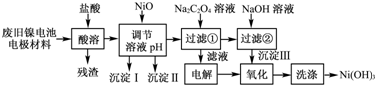
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+.
②已知实验温度时的溶解度:NiC2O4>NiC2O4?H2O>NiC2O4?2H2O
③某温度下一些金属氢氧化物的Ksp及沉淀析出的理论pH如下表所示:
| M(OH)n | Ksp | |
pH
开始沉淀
沉淀完全
Al(OH)3
1.9×10-23
3.4
4.2
Fe(OH)3
3.8×10-38
2.5
2.9
Ni(OH)2
1.6×10-14
7.6
9.8
|
回答下列问题:
(1)用NiO调节溶液的pH,依次析出沉淀Ⅰ______和沉淀Ⅱ______(填化学式).
(2)写出加入Na2C2O4溶液的反应的化学方程式:______.
(3)检验电解滤液时阳极产生的气体的方法:______.
(4)写出“氧化”反应的离子方程式:______.
(5)如何检验Ni(OH)3已洗涤干净?______.
参考答案:(1)根据表中开始沉淀和沉淀完全PH,Fe(OH)3开始沉淀PH2.5沉淀完全PH2.9,Al(OH)3开始沉淀3.4沉淀完全PH4.2,故答案为:Fe(OH)3 Al(OH)3
(2)NiCl2可与Na2C2O4反应生成NiC2O4?2H2O和NaCl,故答案为:NiCl2+Na2C2O4+2H2O═NiC2O4?2H2O↓+2NaCl
(3)滤液为氯化钠溶液,电解时阳极产生氯气,氯气有强氧化性,故可用湿润的淀粉碘化钾试纸,故答案为:用湿润的淀粉碘化钾试纸
(4)过滤2得到Ni(OH)2电解滤液1产生氯气,二者发生氧化还原反应,离子方程式为2Ni(OH)2+2OH-+Cl2═2Ni(OH)3+2Cl-,故答案为:2Ni(OH)2+2OH-+Cl2═2Ni(OH)3+2Cl-
(5)取最后一次洗涤浸出液,加入硝酸银溶液,若有白色沉淀生成,则说明未洗涤干净,若无白色沉淀,说明已洗涤干净,故答案为:取最后一次洗涤液,加入AgNO3溶液,如有白色沉淀生成,再加入稀硝酸,若沉淀不溶解,证明沉淀已洗涤干净.
本题解析:
本题难度:一般
2、选择题 已知:⑴混合硫酸铜溶液与碳酸钠溶液:
主要反应:Cu2++CO32-+H2O=Cu(OH)2↓+CO2↑
次要反应:Cu2++CO32-=CuCO3↓
⑵混合硫酸铜溶液与硫化钠溶液:
主要反应:Cu2++S2-=CuS↓
次要反应:Cu2++S2-+2H2O=Cu(OH)2↓+H2S↑
由此可得以下几种物质溶解度大小关系正确的是(?)
A.Cu(OH)2>CuCO3>CuS
B.Cu(OH)2<CuCO3<CuS
C.CuS >Cu(OH)2>CuCO3
D.CuS <Cu(OH)2<CuCO3
参考答案:D
本题解析:由⑴可知,在水溶液中Cu2+与CO32-主要生成Cu(OH)2沉淀,说明Cu(OH)2比CuCO3更易沉淀,从而说明溶解度:Cu(OH)2<CuCO3;同理由⑵可得,溶解度:CuS <Cu(OH)2。
本题难度:一般
3、填空题 (17分)铜在工农业生产中有着广泛的用途。
(1)配制CuSO4溶液时需加入少量稀H2SO4,其原因是 (只写离子方程式)。
(2)某同学利用制得的CuSO4溶液,进行以下实验探究。
①图甲是根据反应Fe+CuSO4=Cu+FeSO4设计成铁铜原电池,请图甲中的横线上完成标注。
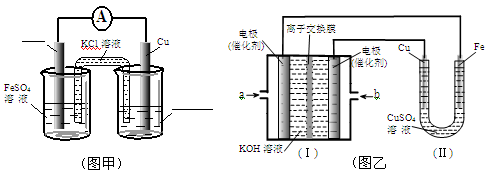
②图乙中,I是甲烷燃料电池的示意图,该同学想在II中实现铁上镀铜,则应在a处通入 (填“CH4”或“O2”),b处电极上发生的电极反应式为 ==4OH-;
若把II中电极均换为惰性电极,电解液换为含有0.1molNaCl溶液400mL,当阳极产生的气体为448mL(标准状况下)时,溶液的pH= (假设溶液体积变化忽略不计)。
(3)电池生产工业废水中常含有毒的Cu2+等重金属离子,常用FeS等难溶物质作为沉淀剂除去[室温下Ksp(FeS)=6.3×10-18mol2·L-2,Ksp(CuS)=1.3×10-36mol2·L-2]。请结合离子方程式说明上述除杂的原理:当把FeS加入工业废水中后,直至FeS全部转化为CuS沉淀,从而除去溶液中Cu2+。
参考答案:(1)Cu2++2H2O Cu(OH)2+2H+
Cu(OH)2+2H+
(2)①(见图)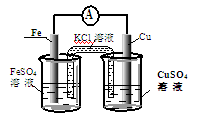
②CH4 O2+4e-+2H2O 13
(3)存在溶解平衡:FeS(s) Fe 2+(aq)+ S 2-(aq),其中的Cu2+与S 2-生成了溶度积更小的CuS沉淀,使得上述溶解平衡继续向右移动。[或用平衡FeS(s)+Cu2+(aq)=" CuS(s)+" Fe 2+(aq)解释]
Fe 2+(aq)+ S 2-(aq),其中的Cu2+与S 2-生成了溶度积更小的CuS沉淀,使得上述溶解平衡继续向右移动。[或用平衡FeS(s)+Cu2+(aq)=" CuS(s)+" Fe 2+(aq)解释]
本题解析:(1)加入稀硫酸是为了抑制Cu2+的水解;(2)图乙在Fe上镀铜,所以Fe作阴极,则连接的为燃料电池的负极,应通入CH4,b极通入O2发生还原反应:O2+4e-+2H2O =4OH-;电解池中均为惰性电极时,阳极的电极反应式为:2Cl--2e-=Cl2↑ ,阴极反应式为:2H++2e-=H2 ↑ .由电极反应式计算消耗的H+为0.04mol,则生成的OH-为0.04mol,c(OH-)=0.1mol/L,则c(H+)=10-13mol/L,pH=13;(3)应用了难溶电解质的沉淀溶解平衡,溶液中存在溶解平衡:FeS(s)  Fe 2+(aq)+ S 2-(aq),Cu2+与S 2-反应可生成溶度积更小的CuS沉淀,使得上述溶解平衡继续向右移动。
Fe 2+(aq)+ S 2-(aq),Cu2+与S 2-反应可生成溶度积更小的CuS沉淀,使得上述溶解平衡继续向右移动。
考点:盐类水解、原电池原理及计算、难溶电解质的沉淀溶解平衡。
本题难度:困难
4、选择题 已知:Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.5×10-16,Ksp(Ag2CrO4)=2.0×10-12,则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是
A.AgCl>AgI>Ag2CrO4
B.AgCl>Ag2CrO4>AgI
C.Ag2CrO4>AgCl>AgI
D.Ag2CrO4>AgI>AgCl