1、选择题 下述实验不能达到预期实验目的的是
选项
| 实验内容
| 实验目的
|
A
| 将2.5 g CuSO4·5H2O溶解在97.5 g 水中
| 配制质量分数为1.6%的CuSO4溶液
|
B
| 向盛有1 mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀生成,再向其中滴加Na2S溶液
| 说明一种沉淀能转化为另一种溶解度更小的沉淀
|
C
| 取少量待检固体溶于水中,滴加少量Ba(OH)2溶液,观察是否有白色沉淀生成
| 检验NaHCO3固体中是否含Na2CO3
|
D
| 取出分液漏斗中所需的上层液体
| 下层液体从分液漏斗下端管口放出,关闭活塞,换一个接收容器,上层液体从分液漏斗上口倒出
|
2、选择题 归纳法是高中化学学习常用的方法之一,某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结:(均在常温下)
①常温下,pH=1的强酸溶液,加水稀释后,溶液中离子浓度都降低。
②pH=2的盐酸和pH=1的盐酸,c(H+)之比为2∶1。
③pH相等的三种溶液:a.CH3COONa? b.NaHCO3? c.NaOH,其溶质物质的量浓度由小到大顺序为:c、b、a
④反应2A (s)+B (g)=2C (g)+D (g)不能自发进行,则该反应△H一定大于0
⑤已知醋酸电离平衡常数为Ka;醋酸根水解常数为Kh;水的离子积为Kw;则三者关系为:Ka·Kh=Kw
⑥反应A(g) 2B(g);△H,若正反应的活化能为Ea kJ·mol-1,逆反应的活化能
2B(g);△H,若正反应的活化能为Ea kJ·mol-1,逆反应的活化能
为Eb kJ·mol-1,则△H =(Ea -Eb)kJ·mol-1。
其归纳正确的是(?)
A.全部
B.③④⑤⑥
C.②④⑤⑥
D.①②④⑤
3、填空题 (7分)(1)现有反应:CO(g)+H2O(g)? CO2(g)+H2(g)? △H>0。在850℃时,K=1。?此温度下,若向一容积可变的密闭容器中同时充入1.0 mol CO,3.0 mol H2O,
CO2(g)+H2(g)? △H>0。在850℃时,K=1。?此温度下,若向一容积可变的密闭容器中同时充入1.0 mol CO,3.0 mol H2O,
1.0 mol CO2和x mol H2,则:
①当x=5.0时,上述反应向? ?方向进行。?
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是? ?。
③在850℃时,若设x=5.0和x=6.0,其他物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则a? b(填“大于”“小于”或“等于”)。
(2)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,它的Ksp=2.8×10—9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10—4mo1/L ,则生成沉淀所需CaCl2溶液的最小浓度为?。
4、选择题 在BaSO3(s)?Ba2+(aq)+SO32- (aq)平衡体系中,下列措施可使沉淀量减少的是( )
A.加入K2SO3(s)
B.加入稀HNO3
C.加入稀盐酸
D.加入K2SO4(s)
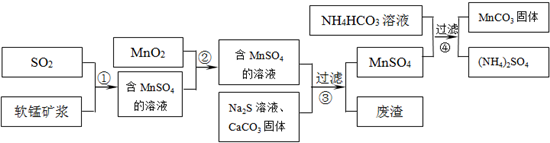
5、简答题 碳酸锰(MnCO3)是理想的高性能强磁性材料,也是制备Mn2O3、MnO2等锰的氧化物的重要原料,广泛用于电子、化工、医药等行业.一种制备MnCO3的生产流程如图所示.
已知生成氢氧化物的pH和有关硫化物的Ksp如下表:
| 物质 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2
开始沉淀pH
2.7
7.6
8.3
完全沉淀pH
3.7
9.6
9.8
|
| 物质 | MnS | CuS | PbS
Ksp
2.5×10-13
6.3×10-36
8.0×10-28
|
软锰矿主要成分为MnO2,其中含有铁、铝、硅的氧化物和少量重金属化合物杂质,SO2来自工业废气.流程①中主要发生的反应有:MnO2+SO2=MnSO4?2Fe3++SO2+2H2O=2Fe2++SO42-+4H+.
(1)流程①中所得MnSO4溶液的pH比软锰矿浆的pH______(填“大”或“小”),该流程可与______(填工业生产名称)联合,生产效益更高.
(2)反应②的目的是将溶液中的Fe2+氧化成Fe3+,其离子反应方程式为______,这样设计的目的和原理是______
(3)反应③中硫化钠的作用是使重金属离子转化为硫化物沉淀,碳酸钙的作用是______.
(4)反应④发生的化学反应为:MnSO4+2NH4HCO3=MnCO3↓+(NH4)2SO4+CO2↑+H2O.
反应中通常需加入稍过量的NH4HCO3,且控制溶液的pH为6.8~7.4.加入稍过量的NH4HCO3的目的是______,溶液的pH不能过低的原因是______.
(5)软锰矿中锰的浸出有两种工艺:
工艺A:软锰矿浆与含SO2的工业废气反应?工艺B:软锰矿与煤炭粉混合,焙烧后加稀硫酸溶解.
其中工艺A的优点是______.(答对1个即可)