1、选择题 在下列变化过程中,既有离子键被破坏又有共价键被破坏的是(?)
A.加热I2使其升华
B.加热NaCl使其熔融
C.将HCl通入水中
D.NaHSO4固体溶于水发生电离
参考答案:D
本题解析:碘升华是物理变化,破坏的是分子间作用力。NaCl在熔融时会电离出离子,破坏的是离子键。HCl溶于水也能电离出离子,但破坏的是共价键。NaHSO4固体溶于水发生电离的方程式为NaHSO4=Na++H++SO42-,所以既破坏离子键,又破坏共价键。答案是D。
本题难度:一般
2、选择题 下列叙述错误的是?(?)
A.H2S、H2O、HF的稳定性依次增强
B.Na+、Mg2+、Al3+的氧化性依次减弱
C.H2SiO3、H2CO3、H2SO4的酸性依次增强
D.KOH、NaOH、Mg(OH)2的碱性依次减弱
参考答案:B
本题解析:B项:Na+、Mg2+、Al3+的氧化性依次增强,故错。故选B。
点评:本题考查金属性和非金属性,明确物质的酸性、碱性、阳离子的氧化性、与非金属性、金属性的关系是解答本题的关键,难度不大
本题难度:简单
3、填空题 现有部分短周期主族元素的有关信息,如下表:
元素编号
| T
| X
| Y
| Z
| W
|
元素的性质或原子结构情况
| 短周期主族元素中原子半径最大
| 最外层上的电子数比次外层少1个且单质是气体
| 核外共有13种运动状态不同的电子
| 若低温蒸发液态空气,因其沸点较低可先获得它的单质
| 核外有5种不同能量的电子且其中有两个未成对的电子
|
?
(1)Y的最外层电子排布式是__?__,它的单质与碳生成的化合物与水反应生成甲烷和白色沉淀。写出该反应的化学方程式__?。
(2)元素T的单质与水反应的离子方程式是?,
在短周期主族元素中,X元素与其相邻元素的原子半径从小到大的顺序是_?
(写元素符号)。
(3)W形成的一种单质,其式量为256,易溶于CS2,该单质的化学式为___?__,它属于_?___晶体(写晶体类型)。
(4)如图为Z元素所在周期气态氢化物R-H键的键能大小,则该周期元素气态氢化物键能大小与键长的关系为_____?(用文字简述)。
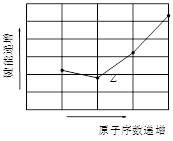
?
参考答案:(1)3s23p1(1分);? Al4C3 + 12H2O →4Al(OH)3 +3CH4↑(1分);
(2)2Na + 2H2O→2Na+ +2OH- +H2↑、( 1分); F、Cl、S(1分);
(3)S8,(1分)?分子(1分);
(4)除CH4外,键长减小,键能增大(2分,“除CH4外”不写只给1分)
本题解析:根据题中所给信息可知:T、Na;X、Cl;Y、Al ;Z、N;W、Si ;
(1)Al 的最外层电子排布式为:3s23p1;它的单质与碳生成的化合物与水反应:Al4C3 + 12H2O →4Al(OH)3 +3CH4↑;
(2)钠的单质与水反应的离子方程式是:2Na + 2H2O→2Na+ +2OH- +H2↑;同周期从左往右半径减小知: F、Cl、S;
(3)根据式量知:S8;?易溶于CS2可知为分子晶体;
(4)结合图像可知:除CH4外,键长减小,键能增大。
本题难度:一般
4、选择题 短周期元素W、X、Y、Z的原子序数依次增大,其简单离子都能破坏水的电离平衡的是
A.W2- X+
B.X+ Y3+
C.Y3+ Z2-
D.X+ Z2-
参考答案:C
本题解析:根据答案选项可知W、X、Y、Z形成的简单离子分别为W2-、X+、Y3+、Z2-,又知W、X、Y、Z均为短周期元素,且原子序数依次增大,故可推出W为O,X为Na,Y为Al,Z为S, Al3+和S2-均能发生水解,水解打破了水的电离平衡。O2-不能在水溶液存在,而Na+不水解。
备注:该题命题结构简单,切入点新颖,考察了离子化合价与其离子电荷的关系,在预测题中也成功预测出相似题型。
本题难度:一般
5、选择题 现有xMm— 和yNn+ 两种简单离子,它们的电子层结构相同。则表示M元素质子数的正确表达式是:
A.x="y-n-m"
B.x="y+n+m"
C.x="y+n-m"
D.x=y-n+m
参考答案:A
本题解析:略
本题难度:简单