1、简答题 我国海岸线漫长,海洋盐矿资源丰富.有一研究性学习小组用某盐场制盐后的苦卤浓缩液(富含Mg2+、Br-、SO42-、Cl-等)制取较纯净的氯化镁晶体及液溴(Br2),设计了如下流程:
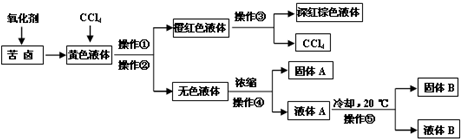
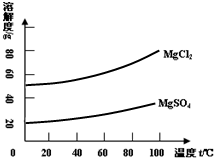
请根据以上流程和图中溶解度曲线,回答相关问题:
(1)苦卤中加的氧化剂是______,其离子方程式为______;
(2)操作①和②所用的仪器是______,操作③的名称是______,操作④的名称是______;
(3)氯化镁晶体是固体______(选填“A”或“B”);
(4)若用化学方法对上述操作②后的无色溶液处理制氯化镁晶体,则需要用到的试剂是(填序号)______;
A、BaCl2?B、CaO?C、Na2CO3?D、HCl
(5)将氯化镁溶液浓缩结晶得到的是MgCl2?6H2O?如要得到无水氯化镁需在干燥的HCl?气流中加热MgCl2?6H2O.其原因是______.
2、选择题 下列实验方案正确且能达到相应实验预期目的的是 (?)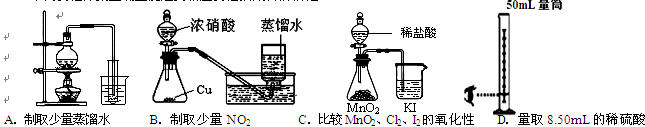
3、实验题 为测定镁铝合金(不含其它元素)中铝的质量分数,甲、乙、丙三个学习小组设计了下列三种不同的实验方案进行探究。请回答下列问题:
 ?(一)甲组:实验方案:镁铝合金
?(一)甲组:实验方案:镁铝合金 测定剩余固体质量
测定剩余固体质量
实验步骤:
①称量:托 盘天平称量一定质量镁铝合金粉末
盘天平称量一定质量镁铝合金粉末
②溶解:将①中药品加入烧杯中,加入过量的NaOH溶液,不断搅拌,充分反应。发生反应的离子方程式为?
③过滤:
④洗涤:若未对过滤所得固体进行洗涤,测得铝的质量分数将?(填“偏高”、“偏低”或“不变”)
⑤干燥、称量剩余固体
 ?(二)乙组:实验方案:镁铝合金
?(二)乙组:实验方案:镁铝合金 测定生成气体的体积
测定生成气体的体积
实验装置如右下图
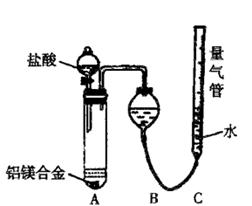
(1)某同学提出该实验装置不够完善,应在A、B之间添加一个装有碱石灰的干燥装置。你的意见是?(填“需要”或“不需要”)
(2)为使测定结果尽可能精确,实验中应注意的问题是(要求写出二点)?、
?
(三)丙组:实验方案:12 g镁铝合金
操作l包括过滤、洗涤、干燥和称量, 并最终得到固体物质1.45g。则该合金中铝的质量分数为?。
并最终得到固体物质1.45g。则该合金中铝的质量分数为?。
4、选择题 下列实验方案中,不能达到实验目的的是
选项
| 实验目的
| 实验方案
|
A
| 检验CH3CH2Br在NaOH溶液中是否发生水解
| 将CH3CH2Br与NaOH溶液共热。冷却后,取出上层水溶液用稀HNO3酸化加入AgNO3溶液,观察是否产生淡黄色沉淀
|
B
| 检验Fe(NO3)2晶体是否已氧化变质
| 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变红
|
C
| 验证Br2的氧化性强于I2
| 将少量溴水加入KI溶液中,再加入CCl4,振荡,静置。可观察到下层液体呈紫色
|
D
| 验证Fe(OH)3的溶解度小于Mg(OH)2
| 将FeCl3溶液加入Mg(OH)2悬浊液中,振荡,可观察到沉淀由白色变为红褐色
5、计算题 某化学课外活动小组设计实验探究氮的化合物的性质,装置如下图所示(A装置未画出),其中A为气体发生装置。A中所用试剂,从下列固体物质中选取:
a. NH4HCO3 b. NH4Cl c. Ca(OH)2 d. NaOH
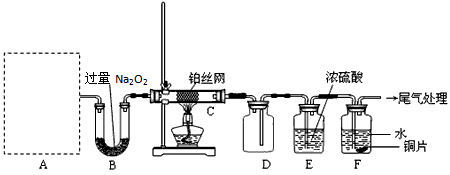
检查装置气密性后,先将C处铂丝网加热至红热,再将A处产生的气体通过B装置片 刻后,撤去C处酒精灯。部分实验现象如下:铂丝继续保持红热,F处铜片逐渐溶解。
(1)实验室制取A中气体时若只用一种试剂,该试剂是_________(填代表备选试剂的字母);此时A中主要的玻璃仪器有_________(填名称)。
(2)A中产生的物质被B中Na2O2充分吸收,写出任意一个B中发生反应的化学方程式:
__________________。
(3)对于C中发生的可逆反应,下列说法正确的_________。
a. 增大一种反应物的浓度可以提高另一种反应物的转化率
b. 工业上进行该反应时,可采取高压的条件提高反应物转化率
c. 该反应在一定条件下达到平衡时,反应物的平衡浓度之比一定是4:5
d. 使用铂丝网可以使正反应速率增大,同时也增大逆反应速率
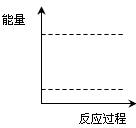
(4)请在下图坐标中画出C装置中反应发生过程中的能量变化示意图(具体能量数值不用标出),并在虚线上分别标出反应物和生成物的化学式。
(5)待实验结束后,将B中固体混合物溶于500 mL 1 mol·L-1 的盐酸中,产生无色混合气体甲,溶液呈中性,则实验前B中原有Na2O2的物质的量是_________mol,甲在标准状况下体积为_________L(忽略气体溶解)。
|