1、填空题 有关催化剂的催化机理等问题可以从“乙醇催化氧化实验”得到一些认识,某教师设计了如图装置(夹持装置仪器已省略),其实验操作为:按图安装好装置,先关闭活塞a、b、c,在铜丝的中间部分加热片刻,然后打开活塞a、b、c,通过控制活塞a和b,而有节奏(间歇性)通入气体,即可在M处观察到明显的实验现象。

(1)A中发生反应的化学方程式:_____________,B的作用:____________; C的作用:____________。
(2)M处发生的反应的化学方程式为:______________________________________?
(3)从M管中可观察到的现象为_______________;从中可认识到该实验过程中催化剂___ __?____(填“参加”或“不参加”)了化学反应
(4)验证乙醇氧化产物的试剂是?,并写出对应的化学方程式?。
(5)若试管F中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有?。要除去该物质,可现在混合液中加入?(填写字母)。
A.氯化钠溶液
B.苯
C.碳酸氢钠溶液
D.四氯化碳
参考答案:(10分)(1)2H2O2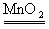 2H2O+O2↑;干燥O2;使D中乙醇变为蒸气进入M中参加反应。
2H2O+O2↑;干燥O2;使D中乙醇变为蒸气进入M中参加反应。
(2)2CH3CH2OH+O2 2CH3CHO+2H2O。
2CH3CHO+2H2O。
(3)受热部分的铜丝由于间歇性地鼓入空气而交替出现变黑,变红的现象, 参加。
(4)银氨溶液或新制Cu(OH)2悬浊液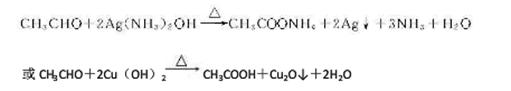
(5)CH3COOH,? C
本题解析:(1)A装置是制备氧气的,其中发生反应的化学方程式是2H2O2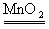 2H2O+O2↑。由于生成的氧气中含有水蒸气,所以B装置中浓硫酸的作用是干燥氧气。而装置C的作用是使D中乙醇变为蒸气进入M中参加反应。
2H2O+O2↑。由于生成的氧气中含有水蒸气,所以B装置中浓硫酸的作用是干燥氧气。而装置C的作用是使D中乙醇变为蒸气进入M中参加反应。
(2)M处是乙醇的催化氧化,所以发生反应的化学方程式为2CH3CH2OH+O2 2CH3CHO+2H2O。
2CH3CHO+2H2O。
(3)由于在反应中真正氧化乙醇的是氧化铜,而不是铜,所以实验中的实验现象是受热部分的铜丝由于间歇性地鼓入空气而交替出现变黑,变红的现象,这说明在反应中催化剂参加了化学反应。
(4)乙醇的氧化产物是乙醛,含有醛基,验证醛基的试剂一般是银氨溶液或新制Cu(OH)2悬浊液,有关反应的化学方程式是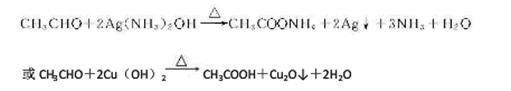 。
。
(5)若试管F中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有乙酸,乙酸显酸性,能使紫色的石蕊试液显红色。而要除去乙酸则应该选择碳酸氢钠,答案选C。
点评:该题是中等难度的试题,试题综合性强,难易适中,贴近高考。该题在注重基础性知识巩固与训练的同时,更侧重对学生实验探究能力的培养。有助于培养学生的逻辑推理能力和严谨的实验设计、操作能力。该题的关键是明确乙醇发生催化氧化的原理,然后结合题意灵活运用即可。
本题难度:一般
2、实验题 某实验小组利用饱和食盐水、导线、直流电源(用 “ ”或“
”或“ ”表示)、烧杯、灵敏电流计(用“
”表示)、烧杯、灵敏电流计(用“ ”表示)和两个电极棒(分别是M、N) 进行电化学实验探究。
”表示)和两个电极棒(分别是M、N) 进行电化学实验探究。
甲同学安装好仪器,接好直流电源通电几分钟,发现M处溶液逐渐变浅绿色,过一段时间,溶液变得浑浊且逐渐出现红棕色。
乙同学所用的仪器和甲同学的看上去相同,但接好直流电源通电几秒钟,却闻到一股刺鼻的气味,马上停止通电。
丙同学安装好仪器,线路闭合几秒钟后,却没有发现明显现象,他又很快接入灵敏电流计,发现电流计的指针发生了偏转。 请根据上述同学的实验现象回答以下问题:
(1)M电极棒材料是(写化学式)___________,N电极棒材料是(写化学式)____________。
(2)在下列虚框内完成对应三个同学的装置图:

(3)按下表要求写出三个同学实验过程中涉及的反应方程式:

(4)用化学方程式解释甲同学实验时观察到M处溶液出现浑浊后转为红棕色现象的原因:________。
(5)丙同学为了保护M电极不被腐蚀,他可以将N电极棒更换为(写化学式) __________。为验证该防护方法有效,他又做下列对比实验:接通电路2分钟后,分别在M电极区滴入2滴黄色K3Fe(CN)6]溶液,发现没有更换N电极棒的烧杯中的现象是__________,发生反应的离子方程式是____________ ,他还可选用的检验试剂是____________。
参考答案:(1) Fe ;C(或Pt等惰性电极)
(2)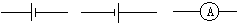
(3)2H++2e-=H2↑? ;Fe-2e-=Fe2+ ;2Cl--2e-=Cl2↑ ;O2+2H2O+4e-=4OH- ;2Cl-+2H2O Cl2↑+H2↑+2OH-?
Cl2↑+H2↑+2OH-?
2Fe+O2+2H2O=2Fe(OH)2
(4)4Fe(OH)2+O2+2H2O=4Fe(OH)3
(5)Zn(合理即可);溶液中产生蓝色沉淀 ;3Fe2++2[Fe( CN)6 ]3-=Fe3[Fe(CN)6]2↓ ;酸性KMnO4溶液或KSCN溶液和氯水
本题解析:
本题难度:一般
3、实验题 工业上常用铁质容器盛装冷浓酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
[探究一]
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移人硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是________________________。
(2)另称取铁钉6.0g放入15.0ml.浓硫酸中,加热,充分应后得到溶液X并收集到气体Y。
①甲同学认为X中除外Fe3+还可能含有Fe2+。若要确认其中的Fe2+,应先用____________(选填序号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.浓氨水 d.酸性 溶液
溶液
②乙同学取336ml(标准状况)气体Y通入足量溴水中,发生反应: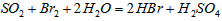
然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g。由于此推知气体Y中SO2的体积分数为
_______。
[探究二]
分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含量有H2和Q气体。为此设计了下列探究实验状置(图中夹持仪器省略)。
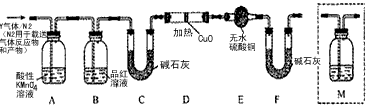
(3)装置B中试剂的作用是____________________。
(4)认为气体Y中还含有Q的理由是________________________(用化学方程式表示)。
(5)为确认Q的存在,需在装置中添加M于_______________(选填序号)。
a. A之前 b.A-B间 c.B-C间 d.C-D间
(6)如果气体Y中含有H2,预计实验现象应是____________________。
(7)若要测定限定体积气体Y中的H2含量(标准状况下约有28ml H2?),除可用测量H2体积的方法外,可否选用质量称量的方法?做出判断并说明理由____________________________________。
参考答案:(1)铁钉表面被钝化(答案合理即可)
(2)①d;②66.7%
(3)检验SO2是否除尽
(4)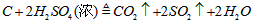
(5)c
(6)D中固体由黑变红和E中固体由白变蓝
(7)否,用托盘天平无法称量D或E的差量(或:可,用分析天平称量D或E的差量)
本题解析:
本题难度:困难
4、实验题 已知明矾[KAl(SO4)2·l2H2O]在水中可解离出K+、Al3+和SO42-,某学习小组为探究明矾中何种离子起净水作用,做如下实验,请你完成实验报告。
(1)
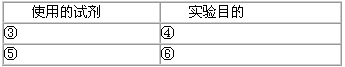
有同学认为以上方案中只是证明了Al2(SO4)3可以净水,K+没有净水作用,但Al3+和SO42-能否净水,不够完善。请你仔细分析以上实验报告并将你完善实验所用的试剂及目的填入下表中:
(2)
参考答案:
(1)烧杯中的水变澄清;K+不能起净水作用
(2)③AlCl3或Al(NO3)3等;④验证Al3+有净水作用;⑤Na2SO4等;⑥验证SO42-没有净化作用
本题解析:
本题难度:一般
5、实验题 请设计CO2在高温下与木炭反应生成CO的实验。
?(1)在下面方框中,A表示由长颈漏斗和锥形瓶组成的气体发生器,请在A后完成该反应的实验装置示意图(夹持装置、连接胶管及尾气处理部分不必画出,需要加热的仪器下方用△标出),按气流方向在每件仪器下方标出字母B、 C……;其他可选用的仪器(数量不限)简易表示如下:
(2)根据方框中的装置图,填写下表

(3)有人对气体发生器作如下改进:在锥形瓶中放人一小试管,将长颈漏斗下端插入小试管中。改进后的优点是_________________________________________________;
(4)验证CO的方法是_____________________________________________。
参考答案:(1)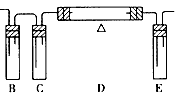
(2)
(3)可以通过控制加酸的量,来控制气体产生的快慢,同时小试管中充满盐酸,可以起到液封作用,防止反应激烈时气体经漏斗冲出
(4)点燃气体,火焰呈蓝色,再用一个内壁附着有澄清石灰水的烧杯罩在火焰上,烧杯内壁的石灰水变浑浊
本题解析:
本题难度:一般