1、实验题 某化学兴趣小组的同学进行草酸亚铁晶体(FeC2O4·nH2O)分解的实验探究。经过小组讨论,他们设计了如下装置进行实验(夹持装置未画出):烧瓶A中盛有饱和NH4Cl和饱和NaNO2的混合液(常用于实验室制N2),干燥管B、G中装有碱石灰,试管D、F、I中盛有澄清石灰水。

(1)连接好装置后,加入药品前,应该进行的实验操作是____________________(填操作名称)。
(2)实验时先打开活塞a,并加热烧瓶A一段时间,其目的是__________________________________________;然后停止加热,关闭活塞a,实验结束前,还要打开活塞a,加热烧瓶A一段时间,其目的是____________________________。
Ⅰ.定性研究
(3)试管D中出现浑浊,证明产物中有____________存在,证明分解产物中存在CO的现象是______________________________________,要证明分解时产生的另一种气态产物的存在应该如何改进装置____________________________;将充分反应后的固体残余物投入经煮沸的稀硫酸中,固体完全溶解且无气体放出,取反应液加入KSCN溶液无血红色,证明固体产物为____________。
Ⅱ.定量分析(假定每一步反应进行完全)
(4)取7.2?g样品进行实验,测得硬质玻璃管C中残余固体2.88?g,硬质玻璃管H中固体质量减轻0.64?g,则草酸亚铁晶体(FeC2O4·nH2O)分解的化学方程式为______________________________________________。
2、实验题 (15分)某实验小组想验证Mg粉和CO2的反应,请从下图中选用所需的仪器(可重复选用)组成一套进行该实验的装置。现提供浓H2SO4、稀盐酸、镁粉、大理石、澄清石灰水,饱和NaHCO3溶液、饱和Na2CO3溶液。(连接和固定仪器用的玻璃管、胶管、铁夹、铁架台及加热装置等均略去)。
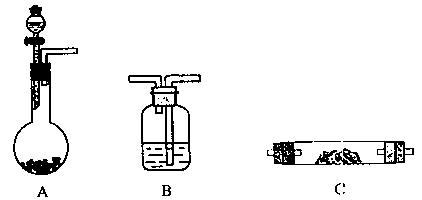
(1)将所选的仪器按连接顺序由上至下依次填入下表,并写出该仪器中应加的试剂(可不填满)
选用的仪器(填字母)
| 加入的试剂
|
A
| 稀盐酸、大理石
|
?
| ?
|
?
| ?
|
?
| ?
|
?
| ?
|
?(2)A中发生反应的离子方程式为?。
(3)组装好仪器,检查气密性良好,加入药品。在加热反应管C之前应进行的操作和目的是
?。
(4)反应中C装置的主要现象是?。
3、选择题 下列实验方案正确且能达到相应实验预期目的的是 (?)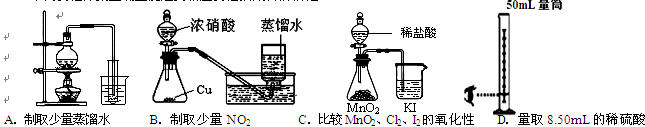
4、选择题 下列用所学知识解释或解决实验中的一些现象和问题,其中合理的是(?)
①配制溶液时,若加水超过容量瓶刻度,应用胶头滴管将多余溶液吸出?
②硫酸铜结晶水含量测定时,需用小火缓慢加热,防止晶体飞溅?
③实验室可用酒精萃取碘水中的碘?
④用加热的方法提纯含有少量碳酸氢钠的碳酸钠?
⑤可用米汤检验食用碘盐中的碘酸钾(KIO3)
⑥贮存Na2CO3时使用橡胶塞;贮存液溴、高锰酸钾时,使用玻璃塞,液溴还需水封
⑦浓硝酸在光照下颜色变黄,说明浓硝酸不稳定
⑧NO2气体通入FeSO4溶液中无现象,说明NO2与FeSO4不反应
⑨在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性
A.①②⑤⑦
B.③④⑥⑨
C.②③⑤⑧
D.②④⑥⑦
5、实验题 某校化学研究性学习小组查阅资料了解到以下内容:乙二酸(HOOC-COOH,可简写为H2C2O4)俗称草酸,易溶于水,属于二元中强酸(为弱电解质),且酸性强于碳酸,其熔点为101.5℃,在157℃升华。为探究草酸的部分化学性质,进行了如下实验:
(1)向盛有1 mL饱和NaHCO3溶液的试管中加入足量乙二酸溶液,观察到有无色气泡产生。该反应的离子方程式为____________________________;
(2)向盛有乙二酸饱和溶液的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现其溶液的紫红色褪去;①说明乙二酸具有_____________(填“氧化性”、“还原性”或“酸性”);
②请配平该反应的离子方程式: ____ MnO4- + ___ H2C2O4 + ____ H+ = ____ Mn2+ + ___ CO2↑ + ____H2O
(3)将一定量的乙二酸放于试管中,按下图所示装置进行实验(夹持装置未标出):
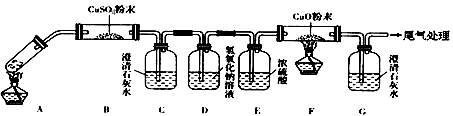
实验发现:装置C、G中澄清石灰水变浑浊,B中CuSO4粉末变蓝,F中CuO粉末变红。据此回答:
①上述装置中,D的作用是__________________,②乙二酸分解的化学方程式为_____________________________________;
(4)该小组同学将2.52 g草酸晶体(H2C2O4·2H2O)加入到100 mL 0.2 mol/L的NaOH溶液中充分反应,测得反应后溶液呈酸性,其原因是___________________________________(用文字简单表述),该溶液中各离子的浓度由大到小的顺序为:___________________(用离子符号表示)。