1、选择题 下列反应中,属于氧化还原反应的是(? )
A.NaOH+HCl====NaCl+H2O
B.2NaOH+CO2====Na2CO3+H2O
C.Cu2S+4H2SO4(浓)====2CuSO4+S↓+2SO2↑+4H2O
D.Ca(HCO3)2+2NaOH====CaCO3↓+Na2CO3+2H2O
参考答案:C
本题解析:根据有化合价升降的反应为氧化还原反应,C中S和Cu元素的化合价有变化,故为氧化还原反应。
本题难度:简单
2、选择题 三氟化氮(NF3)是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生反应:
3 NF3 + 5 H2O =" 2" NO + HNO3 + 9 HF。下列有关该反应的说法正确的是
A.NF3是氧化剂,H2O是还原剂
B.还原剂与氧化剂的物质的量之比为2:1
C.若生成0.2 mol HNO3,则转移0.2 mol电子
D.NF3在潮湿的空气中泄漏会产生红棕色气体
参考答案:D
本题解析:A.在反应3 NF3 + 5 H2O =" 2" NO + HNO3 + 9 HF中,N的化合价由+3→+2、+5,其它元素的化合价没有变化,因此NF3既是氧化剂又是还原剂。错误。N的化合价由+3→+2降低1价,N的化合价由+3→+5,升高了2价,根据氧化反应反应中化合价升降总数相等,所以发生变化+3→+2,得到电子作氧化剂的N为2个,发生变化+3→+5,失去电子作还原剂的N为1个,因此还原剂与氧化剂的物质的量之比为1:2。错误。C.根据方程式可知:若生成0.1 mol HNO3,则转移0.2 mol电子.错误。D.NF3在潮湿的空气中先发生反应3 NF3 + 5 H2O =" 2" NO + HNO3 + 9 HF,后又发生反应:2NO+O2=2NO2。由于含有NO2,所以泄漏会产生红棕色气体。正确。
本题难度:一般
3、选择题 下列说法正确的是
[? ]
A.复分解反应不一定是氧化还原反应
B.置换反应有可能是非氧化还原反应
C.化合反应一定是氧化还原反应
D.分解反应不一定是氧化还原反应
参考答案:D
本题解析:
本题难度:简单
4、选择题 在反应3BrF3+5H2O====HBrO3+Br2+9HF+O2↑中,若有3 mol水作还原剂时,被水还原的BrF3的物质的量为(?)
A.3 mol
B.2 mol
C. mol
mol
D.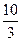 mol
mol
参考答案:B
本题解析:设被水还原的BrF3的物质的量为x。根据电子守恒知:
3 mol×2=x·3
x="2" mol
或根据化学方程式可知,2 mol水可还原 ?mol BrF3,那么,3 mol水还原的BrF3的物质的量为x。则:
?mol BrF3,那么,3 mol水还原的BrF3的物质的量为x。则:
3 mol∶x="2" mol∶ ?mol
?mol
x="2" mol
本题难度:简单
5、填空题 某学生两次分别用2.6 g锌与硝酸溶液进行反应,两次所用的硝酸溶液中均含有6.3 g的HNO3,但浓度不同,均恰好完全反应。又已知第一次实验中有1/5的HNO3被还原,第二次实验中只有1/10的HNO3被还原。试写出相应的反应方程式___________________________
_______________________________________________________________________________。
参考答案:4Zn+10HNO3====4Zn(NO3)2+N2O↑+5H2O
4Zn+10HNO3====4Zn(NO3)2+NH4NO3+3H2O
本题解析:2.6 g Zn为0.04 mol,6.3 g HNO3为0.1 mol。第一次实验:
0.04 mol×2=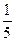 ×0.1 mol×(5-n)
×0.1 mol×(5-n)
n=+1,即生成物为N2O。
第二次实验:
0.04 mol×2=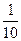 ×0.1 mol×(5-n)
×0.1 mol×(5-n)
n=-3,即还原产物为NH4NO3。
本题难度:简单